题目内容
17.不用化学方法进行鉴别,通过黄色的过氧化钠变为白色的粉末的实验事实证明Na2O2已变质,变质的过程中发生的三个化学方程式是(不考虑Na2CO3•10H2O的形成和风化;是氧化还原的标出电子的转移方向和数目):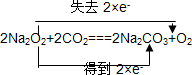 、
、 、2aOH+CO2=Na2CO3+H2O.
、2aOH+CO2=Na2CO3+H2O.
分析 过氧化钠与氧化钠的颜色不同,过氧化钠为淡黄色固体,而氧化钠为白色,过氧化钠易与空气中水、二氧化碳反应而变质,以此解答该题.
解答 解:过氧化钠与氧化钠的颜色不同,过氧化钠为淡黄色固体,而氧化钠为白色,可通过颜色判断是否变质,
过氧化钠与二氧化碳反应生成碳酸钠和氧气,发生2Na2O2+2CO2═2Na2CO3+O2,只有Na2O2中O元素的化合价发生变化,分别由-1价变化为0价和-2价,用双线桥法可表示为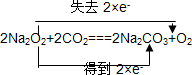 ,
,
与水反应生成氢氧化钠和氧气,在Na2O2与H2O的反应中,化合价升高数=化合价降低数=转移电子数=2,电子转移情况为: ,
,
生成的NaOH和二氧化碳反应生成碳酸钠,方程式为2aOH+CO2=Na2CO3+H2O,
故答案为:黄色的过氧化钠变为白色的粉末;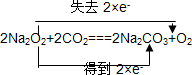 、
、 、2aOH+CO2=Na2CO3+H2O.
、2aOH+CO2=Na2CO3+H2O.
点评 本题考查钠的重要化合物,侧重于元素化合物知识的综合理解和运用的考查,注意把握过氧化钠的性质以及氧化还原反应等知识,难度不大.

练习册系列答案
相关题目
7.下列有关碱金属铷(Rb)的叙述中,不正确的是( )
| A. | Rb2CO3易溶、易电离 | |
| B. | Rb位于周期表第五周期第ⅠA族 | |
| C. | 在钠、钾、铷三种单质中,铷的熔点最高 | |
| D. | 氢氧化铷和盐酸反应的离子方程式是OH-+H+═H2O |
8.下列说法中正确的是( )
| A. | 2mol水的摩尔质量是1mol 水的摩尔质量的2倍 | |
| B. | 阿伏伽德罗常数就是6.02×1023 | |
| C. | 6.02×1023 mol-1叫做阿伏伽德罗常数 | |
| D. | 科学上规定含6.02×1023个粒子的任何粒子集合体计量为1mol |
5.下列五个图中,横坐标表示加入的物质的量,纵坐标表示生成沉淀的量从A-E中选择各题要求的序号填入表中
| 溶液 | 加入的物质 | 答案序号 |
| 饱和石灰水 | 通CO2至过量 | |
| AlCl3溶液 | 通过量的NH3 | |
| 含少量NaOH的NaAlO2溶液 | 通过量的CO2 | |
| NaAlO2溶液 | 滴加稀HCl至过量 | |
| MgCl2 AlCl3的混和液 | 滴加NaOH至过量 |
| A. |  | B. | 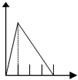 | C. |  | D. |  | ||||
| E. |  |
12.在含有Cu(NO3)2和AgNO3的溶液中加入适量的锌粉,首先置换出的是( )
| A. | Mg | B. | Cu | C. | Ag | D. | H2 |
9.高温下,硫酸亚铁发生如下反应:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑.若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )
| A. | BaSO4 | B. | BaS | C. | BaSO3 | D. | BaSO3和BaSO4 |