题目内容
【题目】I.根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是__________________________。
(2)下图是198 K时N2与H2反应过程中能量变化的曲线图。
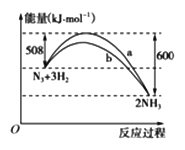
该反应的热化学方程式为:_____________________。
(3)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态水。已知室温下1 g甲硅烷自燃放出热量44.6 kJ,其热化学方程式是___________________。
II.
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_____________________。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为__________________________。
【答案】 S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1 N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ·mol-1 SiH4(g)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1427.2 kJ/mol C H2+2OH--2e=2H2O
【解析】I.(1)16g固体硫完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出放出296.8kj热量,则热化学方程式为:S(s)+O2(g)=SO2(g);△H=-296.8kJ/mol;
(2)该反应放出的能量大于吸收的能量,所以放热,△H=放出的能量-吸收的能量=600kJ/mol-508kJ/mol=92kJ/mol,该反应的热化学方程式为:N2(s)+3H2(g)=2NH3(g) △H=-92kJ/mol;
(3)n(SiH4)=![]() =
=![]() mol,则1molSiH4燃烧放出的热量为:44.6kJ×32=1427.2kJ,反应的化学方程式为:SiH4+O2=SiO2+H2O,则热化学方程式为:SiH4(g)+O2(g)=SiO2(g)+2H2O;△H=-1427.2kJ/mol;
mol,则1molSiH4燃烧放出的热量为:44.6kJ×32=1427.2kJ,反应的化学方程式为:SiH4+O2=SiO2+H2O,则热化学方程式为:SiH4(g)+O2(g)=SiO2(g)+2H2O;△H=-1427.2kJ/mol;
II.(1)A.C(s)+CO2(g)=2CO(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故B错误;C.2H2(g)+O2(g)═2H2O(l)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故C正确;故选C;
(2)氢氧燃烧电池,负极上氢气发生氧化反应,在碱性条件下生成水,发生的电极反应为H2+2OH--2e=2H2O。

 名校课堂系列答案
名校课堂系列答案