题目内容
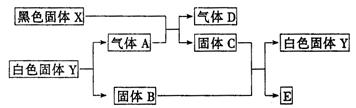
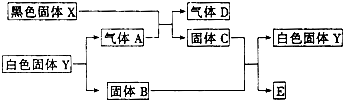
已知黑色固体X可溶于盐酸,白色固体Y既可溶于盐酸,又可溶于NaOH溶液,C为棕红色,E是金属,如图所示,它们之间有下列变化(其反应条件均略去):
(1)写出化学式:X
(2)写出Y溶于NaOH溶液的离子方程式:
(3)写出B与C反应的化学方程式:

(1)写出化学式:X
FeS
FeS
;DSO2
SO2
;(2)写出Y溶于NaOH溶液的离子方程式:
Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
;(3)写出B与C反应的化学方程式:
2Al+Fe2O3
2Fe+Al2O3
| ||
2Al+Fe2O3
2Fe+Al2O3
.
| ||
分析:C为棕红色固体,为Fe2O3,E是金属,由转化关系Fe2O3+B→Y+E,白色固体Y既可溶于盐酸,又可溶于NaOH溶液,考虑铝热反应,B为Al,Y为Al2O3,Al2O3
Al+O2,故A为O2,黑色固体X+O2→Fe2O3+D,D为气体,黑色固体X可溶于盐酸,X含有铁元素,考虑类似硫铁矿燃烧,故X为FeS,D为SO2,验证符合转化关系.
| 电解 |
解答:解:C为棕红色固体,为Fe2O3,E是金属,由转化关系Fe2O3+B→Y+E,白色固体Y既可溶于盐酸,又可溶于NaOH溶液,考虑铝热反应,B为Al,Y为Al2O3,Al2O3
Al+O2,故A为O2,黑色固体X+O2→Fe2O3+D,D为气体,黑色固体X可溶于盐酸,X含有铁元素,考虑类似硫铁矿燃烧,故X为FeS,D为SO2,
(1)由上述分析可知,X为FeS;D为SO2;
故答案为:FeS;SO2;
(2)Al2O3溶于NaOH溶液生成偏铝酸钠与水,反应离子方程式:Al2O3+2OH-=2AlO2-+H2O;
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)Al与Fe2O3在高温的条件下反应生成Fe、Al2O3,反应方程式为:2Al+Fe2O3
2Fe+Al2O3;
故答案为:2Al+Fe2O3
2Fe+Al2O3.
| 电解 |
(1)由上述分析可知,X为FeS;D为SO2;
故答案为:FeS;SO2;
(2)Al2O3溶于NaOH溶液生成偏铝酸钠与水,反应离子方程式:Al2O3+2OH-=2AlO2-+H2O;
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)Al与Fe2O3在高温的条件下反应生成Fe、Al2O3,反应方程式为:2Al+Fe2O3
| ||
故答案为:2Al+Fe2O3
| ||
点评:本题以元素化合物的推断为载体考查了元素化合物的性质,难度中等,能正确推断元素是解本题的关键,在熟练掌握元素化合物知识的基础上着重考查学生的发散思维、分析判断、逻辑思维以及对无机物知识的综合应用等能力.

练习册系列答案
相关题目