��Ŀ����
����Ŀ��������Ҫ�ĵ��ʣ��ϳ�ԭ��Ϊ��N2��g��+3H2��g�� ![]() 2NH3��g����H=��92.4kJ/mol���ش��������⣺
2NH3��g����H=��92.4kJ/mol���ش��������⣺
��1��д��ƽ�ⳣ��K�ı���ʽ �� ��������¶ȣ��÷�ӦKֵE����ѧ��Ӧ���� �� N2��ת���������������С�����䡱����
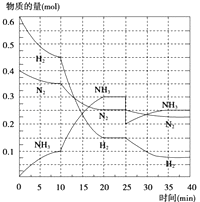
��2����500�桢20MPaʱ����N2��H2����һ���ݻ�Ϊ2L���ܱ������з�����Ӧ����Ӧ�����и������ʵ����仯��ͼ��ʾ���ش��������⣺ 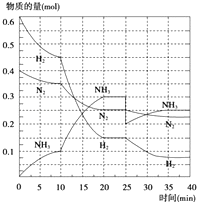
��10min����NH3��ʾ��ƽ����Ӧ���ʣ� ��
����10��20min�ڣ�NH3Ũ�ȱ仯��ԭ�������
A�����˴��� B����С�������
C�������¶� D������NH3���ʵ���
�۵�1��ƽ���ʱ��Ϊ�� �� ��2��ƽ���ʱ��Ϊ�� �� ��1��ƽ�⣺ƽ�ⳣ��K1=�������ݵı���ʽ������2��ƽ��ʱNH3�����������
���ڷ�Ӧ������25minʱ�����߷����仯��ԭ�� ��
��ڶ���ƽ��ʱ����ƽ���ƽ�ⳣ��K2K1 �� ������ڡ�����С�ڡ����ڡ�����
���𰸡�
��1��K= ![]() ����������
����������
��2��0.005mol/��L��min����A��20��25min��35��40min��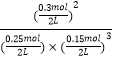 ��45.5%������0.1molNH3������
��45.5%������0.1molNH3������
���������⣺��1����ѧƽ�ⳣ����ƽ��ʱ��������Ũ�ȵĻ�ѧ���������ݵij˻����Ը���Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻����õı�ֵ������N2��g��+3H2��g�� ![]() 2NH3��g�����÷�Ӧ��ƽ�ⳣ������ʽK=
2NH3��g�����÷�Ӧ��ƽ�ⳣ������ʽK= ![]() ����ѧ��Ӧ���¶ȵ����߷�Ӧ���ʼӿ죬���¶ȵĽ��ͣ���Ӧ���ʼ��������Խ����¶Ȼ�Ѩ��Ӧ���ʼ�������ѧƽ��ķ�Ӧ�������¶������ȵķ����ƶ����÷�Ӧ����ӦΪ���ȷ�Ӧ�������¶ȣ���ѧƽ��������Ӧ�����ƶ������Ե�����ת��������
����ѧ��Ӧ���¶ȵ����߷�Ӧ���ʼӿ죬���¶ȵĽ��ͣ���Ӧ���ʼ��������Խ����¶Ȼ�Ѩ��Ӧ���ʼ�������ѧƽ��ķ�Ӧ�������¶������ȵķ����ƶ����÷�Ӧ����ӦΪ���ȷ�Ӧ�������¶ȣ���ѧƽ��������Ӧ�����ƶ������Ե�����ת��������
���Դ��ǣ� ![]() �����٣�����2���ٸ��ݷ�Ӧ����v��NH3��=
�����٣�����2���ٸ��ݷ�Ӧ����v��NH3��= ![]() =
= ![]() =0.005mol/��L��min����
=0.005mol/��L��min����
���Դ��ǣ�0.005mol/��L��min����
����ͼ���֪��������ʵ����仯���ӣ���10minʱ�仯�������ģ�20min��ƽ��ʱ����n��N2��=0.025mol��4=0.1mol��
��n��H2��=0.025mol��12=0.3mol����n��NH3��=0.025mol��8=0.2mol�����ʵ����仯֮�ȵ��ڻ�ѧ������֮�ȣ������������ʵ��������ӱ�����ͬ��˵��10min���ܸı��������ʹ�ô�������С����൱������ѹǿ��Ӧ�÷�Ӧ����������ӱ��������¶ȣ�Ӧ�÷�Ӧ���ʼ�С������NH3���ʵ������淴Ӧ�������ӵı�����ֻ��ʹ�ô������ϣ�
��ѡA��
����ͼ����Կ���������Ӧ���е�ʱ20��25min�������ʵ������䣬˵����Ӧ�ﵽƽ��״̬����ѧƽ�ⳣ������������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ���ͼ���֪��20min��ƽ��ʱ��n��N2��=0.025mol��10=0.25mol��n��H2��=0.025mol��6=0.15mol��n��NH3��=0.025mol��12=0.3mol������������ƽ�ⳣ��K= ![]() =
= 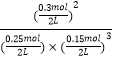 =426.7����2��ƽ��ʱNH3���������=
=426.7����2��ƽ��ʱNH3���������= ![]() ��100%=45.5%��
��100%=45.5%��
���Դ��ǣ�20��25min��35��40min�� 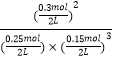 ��45.5%��
��45.5%��
�ܵ�25���ӣ�NH3�����ʵ���ͻȻ���٣���H2��N2�����ʵ������䣬˵��Ӧ�Ƿ����NH3����ͼ����Կ���������Ӧ���е�ʱ35��40min�������ʵ������䣬˵����Ӧ�ﵽ�ڶ���ƽ��״̬��ƽ�ⳣ��ֻ���¶�Ӱ�죬�¶Ȳ��䣬ƽ�ⳣ�����䣬���Գ�ȥ0.1mol������ʱƽ�ⳣ��K�����䣻
���Դ��ǣ������0.1molNH3�����ڣ�
�����㾫����������Ҫ�����˷�Ӧ���ʵĶ�����ʾ�����ͻ�ѧƽ�ⳣ���ĺ�������֪ʶ�㣬��Ҫ���շ�Ӧ���ʵĵ�λ��mol/(L��min)��mol/(L��s) v=��c-��t��ָ��һ�������µĿ��淴Ӧ�����Ӧ���淴Ӧ��������ȣ���Ӧ������и���ֵ�Ũ�Ȳ����״̬������ȷ�����⣮

 �������Ӳ�ϵ�д�
�������Ӳ�ϵ�д� ���ɿ��õ�Ԫ����AB��ϵ�д�
���ɿ��õ�Ԫ����AB��ϵ�д�