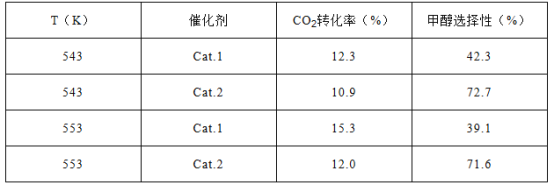
��Ŀ����
����Ŀ��A��B��C��D��EΪԭ��������������Ķ�����Ԫ�أ���֪A��B��E3��ԭ������㹲��11�����ӣ�����3��Ԫ�ص�����������ˮ�����������ܷ�����Ӧ�����κ�ˮ��CԪ�ص������������ȴ�����������4��DԪ��ԭ�Ӵ�����������������������3��
��1��д��Ԫ�ص����ƣ�C �� D��
��2��д��Ԫ�ص�ԭ�ӽṹͼ��
A �� B �� �������Ӱ뾶���������ӷ��ţ���
��3��A��B������������ˮ����ļ��������ѧʽ����ͬ��
��4��D��E����̬�⻯����ȶ��ԣ��� ��
���𰸡�
��1��Si��P
��2��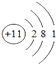 ��
��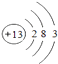 ��Na+��Al3+
��Na+��Al3+
��3��NaOH��Al��OH��3
��4��HCl��PH3
���������⣺A��B��C��D��EΪԭ��������������Ķ�����Ԫ�أ�CԪ�ص������������ȴ�����������4����CԪ��ԭ����3�����Ӳ㣬����������Ϊ4����CΪSiԪ�أ�DԪ��ԭ���������ڹ�Ԫ�أ����ڵ������ڣ�DԪ��ԭ�Ӵ�����������������������3��������������Ϊ8��3=5����DΪ��Ԫ�أ�A��B��E����Ԫ�ص�����������ˮ�����������ܷ�����Ӧ�����κ�ˮ��Ӧ������������ǿ�ᡢǿ��֮��ķ�Ӧ����AΪNa��BΪAl������ԭ������㹲��11�����ӣ���E������������Ϊ11��1��3=7����EΪClԪ�أ���1�������Ϸ�����֪��CΪSi��DΪP�����Դ��ǣ�Si��P����2��AΪNa��ԭ�ӽṹʾ��ͼΪ 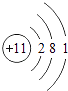 ��BΪAl��ԭ�ӽṹʾ��ͼΪ��
��BΪAl��ԭ�ӽṹʾ��ͼΪ�� 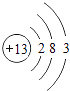 ��Na+��Al3+���ӶԳƽṹ��ͬ���˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶��Na+��Al3+ ��
��Na+��Al3+���ӶԳƽṹ��ͬ���˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶��Na+��Al3+ ��
���Դ��ǣ� 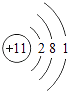 ��
�� 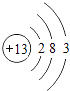 ��Na+��Al3+����3��������Խǿ������������ˮ����ļ���Խǿ��������Na��Al������ԣ�NaOH��Al��OH��3 �� ���Դ��ǣ�NaOH��Al��OH��3����4��ͬ����������ҷǽ�������ǿ��Ԫ�صķǽ�����Խǿ���⻯��Խ�ȶ������⻯���ȶ��ԣ�HCl��PH3 �� ���Դ��ǣ�HCl��PH3 ��
��Na+��Al3+����3��������Խǿ������������ˮ����ļ���Խǿ��������Na��Al������ԣ�NaOH��Al��OH��3 �� ���Դ��ǣ�NaOH��Al��OH��3����4��ͬ����������ҷǽ�������ǿ��Ԫ�صķǽ�����Խǿ���⻯��Խ�ȶ������⻯���ȶ��ԣ�HCl��PH3 �� ���Դ��ǣ�HCl��PH3 ��