题目内容
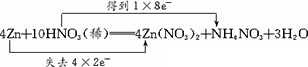
用“双线桥”表示下列氧化还原反应中电子转移的方向和总数,并填空:
4Zn+10HNO3(稀)![]() 4Zn(NO3)2+NH4NO3+3H2O
4Zn(NO3)2+NH4NO3+3H2O
该反应中氧化剂和还原剂的质量比是________,该反应改写为离子方程式是________.
答案:
解析:
解析:
|
答案:
63∶260 4Zn+10H++ 解析:反应中,改变化合价的元素是Zn和N,箭头要从反应物指向生成物,4 mol Zn失去8 mol e-,10 mol HNO3中只有1 mol HNO3得到电子,N的化合价从HNO3中的+5价变为NH4NO3中的-3价; 氧化剂和还原剂的质量比是1 mol HNO3和4 mol Zn的质量比即:63∶260; HNO3、Zn(NO3)2、NH4NO3是易溶于水的强电解质,改写为离子形式,两边删除9 mol |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目