题目内容
在恒容的密闭容器中充入适量NO2,发生如下反应:2NO2(g)?N2O4(g),当分离出部分N24时,下列说法中正确的是( )A.v(正)增大
B.平衡逆向移动
C.v(正)>v(逆)
D.N02转化率不变
【答案】分析:恒容的密闭容器中充入适量NO2,发生反应2NO2(g)?N2O4(g),当分离出部分N24时,瞬间NO2的浓度不变,N24的浓度减小,平衡正向移动,v(正)>v(逆),正反应速率在减小,直到正逆反应速率相等,以此来解答.
解答:解:A.分离出部分N24时,瞬间NO2的浓度不变,N24的浓度减小,平衡正向移动,v(正)>v(逆),正反应速率在减小,直到正逆反应速率相等,故A错误;
B.减小生成物的浓度,平衡正向移动,故B错误;
C.由A可知,减小生成物浓度,平衡正向移动,v(正)>v(逆),故C正确;
D.因平衡向正反应方向移动,则N02转化率增大,故D错误;
故选C.
点评:本题考查化学平衡的移动,明确减小生成物的浓度对化学平衡和化学反应速率的影响是解答本题的关键,注意“当分离出部分N24时,瞬间NO2的浓度不变,N24的浓度减小”,题目难度不大.
解答:解:A.分离出部分N24时,瞬间NO2的浓度不变,N24的浓度减小,平衡正向移动,v(正)>v(逆),正反应速率在减小,直到正逆反应速率相等,故A错误;
B.减小生成物的浓度,平衡正向移动,故B错误;
C.由A可知,减小生成物浓度,平衡正向移动,v(正)>v(逆),故C正确;
D.因平衡向正反应方向移动,则N02转化率增大,故D错误;
故选C.
点评:本题考查化学平衡的移动,明确减小生成物的浓度对化学平衡和化学反应速率的影响是解答本题的关键,注意“当分离出部分N24时,瞬间NO2的浓度不变,N24的浓度减小”,题目难度不大.

练习册系列答案
相关题目
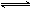 xC(g),达到平衡后,C的体积分数为m%.若维持容器容积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质的量,达到平衡后,C的体积分数仍为m%.则x的值可能为
xC(g),达到平衡后,C的体积分数为m%.若维持容器容积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质的量,达到平衡后,C的体积分数仍为m%.则x的值可能为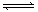 xC(g),达到平衡后,C的体积分数为m%。若维持容器容积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质的量,达到平衡后,C的体积分数仍为m%。则x的值可能为
xC(g),达到平衡后,C的体积分数为m%。若维持容器容积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质的量,达到平衡后,C的体积分数仍为m%。则x的值可能为