��Ŀ����
����Ŀ������Ҫ��ش��������⣺
��ͼΪʵ����ijŨ�����Լ�ƿ�ı�ǩ���Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺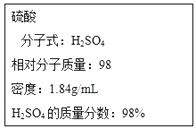
��1����Ũ������H2SO4�����ʵ���Ũ��Ϊ
��2��ijѧ����������Ũ���������ˮ����250mL���ʵ���Ũ��Ϊ0.4molL��1��ϡ���ᣬ��ѧ����Ҫ��ȡ����Ũ����������ƣ�
��3��Ϊ���ƣ�2���е�ϡ���ᣬ���пɹ�ѡ�õ������У�һ���õ����������ţ������ƹ����л�ȱ�ٵ�����������д�������ƣ�
�ٲ��������ڽ�ͷ�ιܣ�����Ͳ����ҩ�ף���Բ����ƿ������ƽ�����ձ�������ͨ©��
��4��ȡ�������ƺõ�������Һ50mL������������Ӧ��������Һ��c��Al3+��=��������Һ����ı仯����������Һ��SO42�����ڵķ�����
���𰸡�
��1��18.4mol/L
��2��5.4mL
��3���٢ڢۢߣ�250mL����ƿ
��4��![]() mol/L��ȡ������Һ�������е������ᣬ�������ټ��Ȼ�����Һ���ְ�ɫ������������SO42��
mol/L��ȡ������Һ�������е������ᣬ�������ټ��Ȼ�����Һ���ְ�ɫ������������SO42��
���������⣺��1��Ũ��������ʵ���Ũ��= ![]() =
= ![]() mol/L=18.4mol/L��
mol/L=18.4mol/L��
�ʴ�Ϊ��18.4mol/L����2��Ũ����ϡ��ǰ�����ʵ����ʵ������䣬Ũ�������= ![]() =5.4mL��
=5.4mL��
�ʴ�Ϊ��5.4mL����3������һ�����ʵ���Ũ��������Һ��Ҫ�������У��ձ�����������250mL����ƿ����ͷ�ιܡ���Ͳ��������Ҫ�������Т٢ڢۢߣ�����Ҫ250mL����ƿ��
�ʴ�Ϊ���٢ڢۢߣ�250mL����ƿ����4�������Al��Ӧ����������������SO42���غ��c[Al2��SO4��3]= ![]() c��H2SO4�����������������Ӻ����������Ũ��Ϊ2��3������c��Al3+��=2c[Al2��SO4��3]=2��
c��H2SO4�����������������Ӻ����������Ũ��Ϊ2��3������c��Al3+��=2c[Al2��SO4��3]=2�� ![]() c��H2SO4��=
c��H2SO4��= ![]() ��0.4mol/L=
��0.4mol/L= ![]() mol/L������������������ữ���Ȼ�����Һ���飬����鷽��Ϊȡ������Һ�������е������ᣬ�������ټ��Ȼ�����Һ���ְ�ɫ������������SO42�� ��
mol/L������������������ữ���Ȼ�����Һ���飬����鷽��Ϊȡ������Һ�������е������ᣬ�������ټ��Ȼ�����Һ���ְ�ɫ������������SO42�� ��
�ʴ�Ϊ�� ![]() mol/L��ȡ������Һ�������е������ᣬ�������ټ��Ȼ�����Һ���ְ�ɫ������������SO42�� ��
mol/L��ȡ������Һ�������е������ᣬ�������ټ��Ȼ�����Һ���ְ�ɫ������������SO42�� ��
��1��Ũ��������ʵ���Ũ��= ![]() ����2��Ũ����ϡ��ǰ�����ʵ����ʵ������䣬�ݴ˼���Ũ�����������3������һ�����ʵ���Ũ��������Һ��Ҫ�������У��ձ�����������250mL����ƿ����ͷ�ιܡ���Ͳ����4�������Al��Ӧ��������������������������غ㼰��������Ӻ������ӹ�ϵ���������ʵ���Ũ�ȣ�����������������ữ���Ȼ�����Һ���飮
����2��Ũ����ϡ��ǰ�����ʵ����ʵ������䣬�ݴ˼���Ũ�����������3������һ�����ʵ���Ũ��������Һ��Ҫ�������У��ձ�����������250mL����ƿ����ͷ�ιܡ���Ͳ����4�������Al��Ӧ��������������������������غ㼰��������Ӻ������ӹ�ϵ���������ʵ���Ũ�ȣ�����������������ữ���Ȼ�����Һ���飮

 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�����Ŀ��NAΪ�����ӵ�������ֵ�����ı������ݣ������ж��ڱ�״������ȷ����
NO2 | HF | |
�۵�/�� | -11.2 | -83.6 |
�е�/�� | 21.0 | 19.52 |
A. 2.0gHF�к�������ĿΪl.0NA
B. 12gʯīϩ(����ʯī)�к�����Ԫ������ΪNA
C. 6.72LNO2��ˮ��Ӧ��ת�Ƶĵ�����Ϊ0.2NA
D. NO��O2��2.24L��ַ�Ӧ�����û������ϵ�к�������Ϊ0.1NA