题目内容
(8分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
□SiO2+□C+□N2 □Si3N4+□CO
□Si3N4+□CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)若知上述反应为放热反应,则其反应热△H 零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);
(4)若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
(5)若已知CO生成速率为v(CO)=18mol/(L.min),则N2消耗速速率为v(N2)= mol/(L.min)。
□SiO2+□C+□N2
 □Si3N4+□CO
□Si3N4+□CO(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)若知上述反应为放热反应,则其反应热△H 零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);
(4)若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
(5)若已知CO生成速率为v(CO)=18mol/(L.min),则N2消耗速速率为v(N2)= mol/(L.min)。
(1)3,6,2,1,6(2分)
(2)N2,Si3N4 (3)小于 减小 (4)逆 (5)6(每空1分)
(2)N2,Si3N4 (3)小于 减小 (4)逆 (5)6(每空1分)
(1)反应中碳元素的化合价从0价升高到+2价,失去2个电子;氮元素的化合价从0价降低到-3价,得到3个电子。所以根据电子的得失守恒可知,还原剂和氧化剂的物质的量之比是3︰1,所以配平后的化学计量数分别依次是3,6,2,1,6。
(2)根据(1)可知氮气是氧化剂,其还原产物是Si3N4。
(3)放热反应的△H小于0。升高温度平衡向吸热的逆反应方向移动,因此平衡常数减小。
(4)根据配平后的方程式可知,正反应是体积增大的,所以增大压强,平衡向逆反应方向移动。
(5)根据反应速率之比是相应的化学计量数之比可知,氮气的消耗速率是18mol/(L.min)÷3=6mol/(L.min)。
(2)根据(1)可知氮气是氧化剂,其还原产物是Si3N4。
(3)放热反应的△H小于0。升高温度平衡向吸热的逆反应方向移动,因此平衡常数减小。
(4)根据配平后的方程式可知,正反应是体积增大的,所以增大压强,平衡向逆反应方向移动。
(5)根据反应速率之比是相应的化学计量数之比可知,氮气的消耗速率是18mol/(L.min)÷3=6mol/(L.min)。

练习册系列答案
相关题目
 pC(g) + qD(g)的平衡常数为K,下列说法正确的是( )
pC(g) + qD(g)的平衡常数为K,下列说法正确的是( ) 
 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是 2HNO3+NO ΔH<0,为提高NO2的转化率,理论上应该采取的措施是( )
2HNO3+NO ΔH<0,为提高NO2的转化率,理论上应该采取的措施是( ) CH3OCH3(g)+H2O(g)的平衡常数为400,此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)的平衡常数为400,此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下: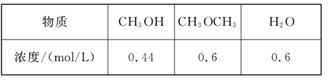
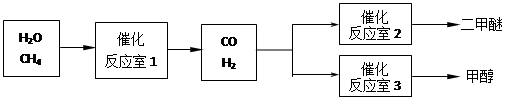
 CO(g)+3H2(g) △H>0。
CO(g)+3H2(g) △H>0。 CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则: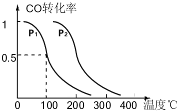
 2Z达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )
2Z达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )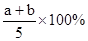

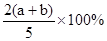
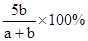
 C(g)+ D(g),能说明该反应达到平衡状态的标志是
C(g)+ D(g),能说明该反应达到平衡状态的标志是