题目内容
【题目】(1)将一定量的A、B、C三种物质(都是气体)放入固定体积为10 L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如下图所示。
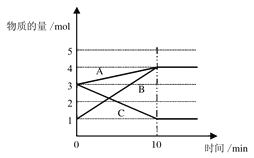
请解答下列问题:
①该反应的的反应物是_______(填字母),生成物是________(填字母),反应的化学方程式用A、B、C可表示为____________________________(用字母表示)
②用B的浓度变化表示在0~10 min内的反应速率是__________
③判断该反应达到化学平衡状态的标志是___________(填字母)
a.A和B浓度相等 b.A百分含量保持不变
c.A的生成速率与B的消耗速率相等 d.容器中气体的压强不变
e.容器中混合气体的密度保持不变
(2)由铜、锌和稀硫酸组成的原电池中,正极是_______(填化学式),发生_______反应,电极反应是________________________;负极是_______(填化学式),发生________反应,总的反应式(离子方程式)是______________________。
(3)从能量的角度看,断开化学键要______能量(填吸收或放出,下同),形成化学键要_____能量。当反应物的总能量高于生成物时,该反应为_______反应(填吸热或放热,下同);当反应物的总能量低于生成物时,该反应为__________反应。
【答案】 C A,B 2C![]() A+3B 0.03mol/(L.min) bd Cu 还原 2H++2e-=H2↑ Zn 氧化 Zn+2H+=Zn2++H2↑ 吸收 放出 放热 吸热
A+3B 0.03mol/(L.min) bd Cu 还原 2H++2e-=H2↑ Zn 氧化 Zn+2H+=Zn2++H2↑ 吸收 放出 放热 吸热
【解析】(1)①由图象可以看出,反应中A、B的物质的量增加,C的物质的量减少,则A、B为生成物,C为反应物,且△n(A):△n(B):△n(C)=1mol:3mol:2mol=1:3:2,则反应的化学方程式为:2CA+3B,故答案为:C;A、B ;2CA+3B;
②v(B)═![]() =
=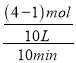 =0.03mol/(Lmin),故答案为:0.03mol/(Lmin);
=0.03mol/(Lmin),故答案为:0.03mol/(Lmin);
③a.A和B浓度相等不能说明浓度是否分数变化,不能说明反应达到化学平衡状态,错误b.A百分含量保持不变,说明A的浓度不再变化,说明反应达到化学平衡状态,正确;c.A的生成速率与B的消耗速率相等,说明正逆反应速率不等,不能说明反应达到化学平衡状态,错误;d.容器中气体的压强不变,说明正逆反应速率相等,说明反应达到化学平衡状态,正确;e.该反应过程中容器中混合气体的密度始终保持不变,不能说明反应达到化学平衡状态,错误;故选bd;
(2)由铜、锌和稀硫酸组成的原电池中,正极是铜,发生还原反应,电极反应为2H++2e-=H2↑;负极是锌,发生氧化反应,电极反应为Zn-2e-=Zn2+,总的反应式为Zn+2H+=Zn2++H2↑,故答案为:Cu;还原;2H++2e-=H2↑; Zn; 氧化;Zn+2H+=Zn2++H2↑;
(3)从能量的角度看,断开化学键要吸收能量,形成化学键要放出能量。当反应物的总能量高于生成物时,该反应为放热反应;当反应物的总能量低于生成物时,该反应为吸热反应,故答案为:吸收;放出; 放热; 吸热。

【题目】利用如图所示装置,采用适当试剂可完成下表的探究实验,并得出相应的实验结论,其中错误的是
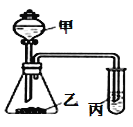
选项 | 甲 | 乙 | __丙 | 装置丙中的现象 | 实验结论 |
A | 稀硝酸 | 碳酸钾 | 澄淸石灰水 | 变浑浊 | 酸性:HNO3>H2CO3 |
B | 稀硫酸 | 碳酸钠 | 次氯酸钙溶液 | 白色沉淀 | 酸性:H2CO3>HClO |
C | 浓盐酸 | 大理石 | 硅酸钠溶液 | 白色沉淀 | 非金属性:C>Si |
D | 浓盐酸 | 高锰酸钾 | 石蕊溶液 | 先变红后褪色 | 氯水既有酸性,又具有漂白性 |
A. A B. B C. C D. D



