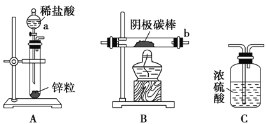
题目内容
【题目】在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中加入足量Na2O2固体,充分作用后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是( )
A.Fe3+、Al3+ B.Fe3+ C.Fe2+、NH4+ D.Al3+
【答案】A
【解析】加入过氧化钠,过氧化钠具有强氧化性且和水反应生成NaOH,Fe2+被氧化生成Fe3+,Al3+→AlO2﹣,Fe3+→Fe(OH)3,NH4+变成氨气放出,加入盐酸后,AlO2﹣和Fe(OH)3分别又生成Al3+、Fe3+,则溶液中Fe3+增多,Fe2+、NH4+减小,Al3+、Fe3+不变,故选A.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案【题目】研究非元素及其化合物的性质具有重要意义。
Ⅰ. 含硫物质燃烧会产生大量烟气,主要成分是SO2、CO2、N2、O2 。某研究性学习小组在实验室利用下列装置制备模拟烟气,并测定烟气中SO2的体积分数。
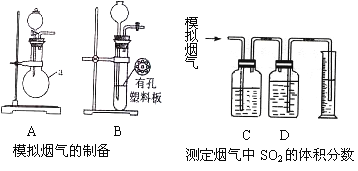
(一)模拟烟气的制备
(1)用A装置制SO2,化学反应方程式为___________________________。
(2)用B装置制CO2,使用该装置优点的是___________________________。
(3)将制得的气体与空气充分混合,获得模拟烟气用于后续实验。
(二)测定烟气中SO2的体积分数
(4)将部分模拟烟气缓慢通过C、D装置,其中C、D中盛有的药品分别是__________、__________。(填序号)
①KMnO4溶液 ②饱和NaHSO3溶液 ③饱和Na2CO3溶液 ④饱和NaHCO3溶液
(5)若模拟烟气的流速为amL/min,若t1分钟后,测得量筒内液体体积为VmL,则SO2的体积分数____________________。
Ⅱ.某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹) 。

(1)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。①若在丙中加入适量水,即可制得氯水。将所得氯水进行实验,实验操作、现象、结论如下:
实验操作 | 现 象 | 结 论 |
氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气和水反应的产物具有酸性 |
实验的结论是否合理__________,(选填合理或不合理)请说明理由______________________。
②请利用上述装置设计一个简单的实验验证Cl-和S2-的还原性强弱,则甲、乙、丙中盛放的试剂是甲__________________ 乙__________________ 丙__________________
(2)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进行NO2有关实验。欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹________,再打开止水夹________,使烧杯中的水进入试管丁的操作是:___________________________________使试管中的气体逸出,NO2与水接触后即可引发烧杯中的水进入试管丁。
【题目】表是A、B、C、D、E五种有机物的有关信息:
A | B | C | D | E |
①能使溴水褪色 | ①由C、H两 | ①由C、H、O三 | ①相对分子质量 | ①由C、H、O三 |
根据表中信息回答下列问题:
(1)A与溴水反应的生成物的名称叫做;写出在一定条件下,A生成高分子化合物的化学方程式: .
(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式 . 当n=时,这类有机物开始出现同分异构体.
(3)B具有的性质是(填序号).
①无色无味液体②有毒③不溶于水④密度比水大⑤任何条件下不与氢气反应⑥可使酸性高锰酸钾溶液和溴水均褪色
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: .
(4)写出由C氧化生成D的化学方程式: .
(5)C与E反应能生成相对分子质量为100的酯,该反应类型为 .