题目内容
【题目】I.合成氨的原料气H2可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
(1)T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 。
(2)保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入固定容器中进行反应,下列描述
能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成amolCO2的同时消耗amolH2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
II.液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
① 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
② 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③ 4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
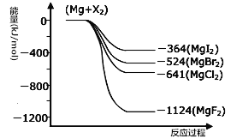
III.(1)右图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应。
(2)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体(CH4)和沉淀生成。写出CH3MgCl水解的化学方程式 。
【答案】I.(1)60%(2)cdII.![]()
III.(1)放热(2)CH3MgCl+H2O═CH4↑+Mg(OH)Cl
【解析】
试题分析:I.(1)依据化学平衡三段式列式计算平衡浓度,℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08molL-1,
CO(g)+H2O(g)═CO2 (g)+H2(g)
起始量(mol/L) 0.2 0.2 0 0
变化量(mol/L) 0.12 0.12 0.12 0.12
平衡量(mol/L) 0.08 0.08 0.12 0.12
平衡时CO的转化率=0.12mol/L÷0.2mol/L×100%=60%;
(2)化学平衡状态,反应的正逆反应速率相同,各成分含量保持不变分析选项,CO(g)+H2O(g)═CO2 (g)+H2(g),反应是气体体积不变反应;a.反应过程中和平衡状态下压强相同,容器内压强不随时间改变,不能说明反应达到平衡状态,故a不符合;b.混合气体质量守恒,反应前后气体体积不变,反应过程中和平衡状态下,混合气体的密度不随时间改变,不能说明反应达到平衡状态,故b不符合;c.单位时间内生成amolCO2的同时消耗amolH2,说明二氧化碳或氢气的正逆反应速率相同,说明反应达到平衡状态,故c符合;d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6,依据反应前后气体物质的量相同,可以利用物质的量代替浓度计算浓度商和平衡常数比较,Q=(6×6)/(1×16)=2.25=K,说明反应达到平衡状态,故d符合;故答案为cd;
II.:(1)由反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H1 ①
4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H2 ②
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H3③
则反应![]() 可得到反应①,则△H1=
可得到反应①,则△H1=![]() ;
;
III.(1)由图象可知,Mg与卤素单质的能量高于卤化物,依据能量守恒判断,反应是放热反应;
(2)CH3MgCl水解化合价不变,CH3MgCl中,Cl元素的化合价是-1价,H元素的化合价是+1价,C元素的化合价是-4价,镁元素的化合价是+2价,所以CH3MgCl水解生成氢氧化镁、氯化氢和甲烷或Mg(OH)Cl,水解方程式为:CH3MgCl+H2O═CH4↑+Mg(OH)Cl↓。

 阅读快车系列答案
阅读快车系列答案【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
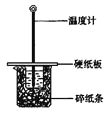
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”、“无影响”,下同) 若用KOH代替NaOH,测定结果会 __ __
(5)他们记录的实验数据如下:
实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
t1 | t2 | ||||
① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | |
② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。