题目内容
某兴趣小组为探究沉淀溶解平衡的原理并测定某温度下PbI2溶度积常数,设计如下实验。
Ⅰ 取100mL蒸馏水,加入过量的PbI2固体(黄色),搅拌,静置,过滤到洁净的烧杯中,得到滤液。
(1)搅拌的目的是?????????????????? 。
(2)取少量滤液于试管中,向其中滴加几滴0.1 mol·L-1KI溶液,观察到的现象是?????? ,溶液中c(Pb2+)????????? (填“增大”、“减小”或“不变”)。
Ⅱ 准确量取10.00mL滤液,与离子交换树脂(RH)发生反应:2RH + Pb2+= R2Pb + 2H+,交换完成后,流出溶液用中和滴定法测得n(H+)=3.000×10-5 mol。
(3)在此实验温度下,PbI2的溶度积常数Ksp=??????????????? 。
(4)若步骤Ⅰ盛装滤液的烧杯中有少量水,Ksp测定结果将会????????? (填“偏大”、“偏小”或“无影响”)。
(1)使碘化铅充分溶解(2分)
(2)产生黄色沉淀或黄色浑浊(2分)??? 减小(1分)
(3)1.35×10-8(2分)
(4)偏小(2分)
【解析】
试题分析:(1)搅拌可以使碘化铅充分溶解。
(2)滤液为PbI2的饱和溶液,加入0.1 mol·L-1KI溶液,增加了I?浓度,使PbI2的沉淀溶解平衡向左移动,生成了PbI2沉淀,所以观察到的现象为:产生黄色沉淀或黄色浑浊;Pb2+部分转化为PbI2沉淀,所以Pb2+浓度减小。
(3)根据方程式可知:n(Pb2+)=1/2n(H+)=1/2×3.000×10-5 mol=1.500×10-5 mol,c(Pb2+)=1.500×10-5 mol÷0.01L=1.500×10-3mol?L?1,则c(I?)=2c(Pb2+)=3.000×10-3mol?L?1,所以Ksp=1.500×10-3mol?L?1×(3.000×10-3mol?L?1)2=1.35×10-8
(4)若步骤Ⅰ盛装滤液的烧杯中有少量水,溶液变稀,准确量取的10.00mL滤液含有的Pb2+减少,所以Ksp测定结果将会偏小。
考点:本题考查基本操作的作用、实验现象的判断、离子浓度判断、溶度积的计算和判断。

(15分)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
⑴孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3。某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L—1的Cu(NO3)2溶液、2.0mL 0.50 mol·L—1的NaOH溶液和0.25 mol·L—1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
| 编号 | V (Na2CO3)/ mL | 沉淀情况 | | 编号 | 反应温度/℃ | 沉淀情况 |
| 1 | 2.8 | 多、蓝色 | | 1 | 40 | 多、蓝色 |
| 2 | 2.4 | 多、蓝色 | | 2 | 60 | 少、浅绿色 |
| 3 | 2.0 | 较多、绿色 | | 3 | 75 | 较多、绿色 |
| 4 | 1.6 | 较少、绿色 | | 4 | 80 | 较多、绿色(少量褐色) |
①实验室制取少许孔雀石,应该采用的条件是 。
②80℃时,所制得的孔雀石有少量褐色物质的原因是 。
⑵实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:
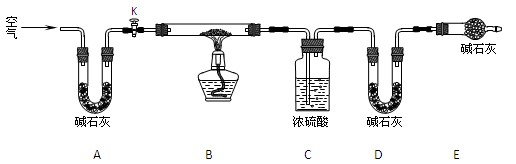
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4: 。
步骤5:称量相关装置的质量。
①装置A的作用是 ;若无装置E,则实验测定的x/y的值将 (选填“偏大”、“偏小”或“无影响”)。
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的 (写出所有组合的字母代号)一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式 。

