题目内容
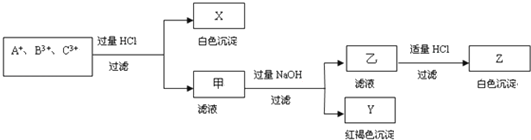
【题目】含有A+、B3+、C3+ 三种金属阳离子的水溶液发生了如下一系列变化:
请通过分析回答(用化学符号填写):
(1)A+是______,B3+是____________,C3+是____________;
(2)X是____________,Y是____________,Z是____________;
(3)写出有关离子方程式:
①生成Y沉淀:_______________________;
②生成Z沉淀:_______________________.
【答案】
(1)Ag+;Fe3+或Al3+;Al3+或Fe3+
(2)AgCl;Fe(OH)3;Al(OH)3.
(3)Fe3++3OH-=Fe(OH)3↓;AlO2-+H++H2O=Al(OH)3↓
【解析】
试题分析:含有A+、B3+、C3+ 三种金属阳离子的水溶液,加入过量盐酸反应过滤得到白色沉淀X和滤液甲,白色沉淀只能是氯化银沉淀,说明A+离子为Ag+,滤液甲中加入过量氢氧化钠溶液过滤得到红褐色沉淀Y为Fe(OH)3,滤液乙中加入适量盐酸反应生成白色沉淀Z为Al(OH)3,说明B3+、C3+ 离子分别为:Fe3+、Al3+或Al3+、Fe3+。
(1)上述分析可知A+、B3+、C3+ 三种金属阳离子分别为:Ag+、Fe3+、Al3+或Ag+、Al3+、Fe3+,故答案为:Ag+、Fe3+、Al3+或Ag+、Al3+、Fe3+;
(2)分析可知对应X、Y、Z分别为:AgCl、Fe(OH)3、Al(OH)3,故答案为:AgCl; Fe(OH)3;Al(OH)3;
(3)①生成Y沉淀的离子方程式为:Fe3++3OH-=Fe(OH)3↓,②生成Z沉淀的反应的离子方程式为:AlO2-+H++H2O=Al(OH)3↓,故答案为:Fe3++3OH-=Fe(OH)3↓;AlO2-+H++H2O=Al(OH)3↓。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案