题目内容
用下面两种方法可以制得白色的Fe(OH)2沉淀。方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还加入___________________________________。
(2)除去蒸馏水中溶解的O2常采用______________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是______________________________________。
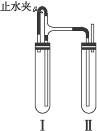
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。

(1)在试管Ⅰ里加入的试剂是____________________________________。
(2)在试管Ⅱ里加入的试剂是____________________________________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是___________________________________________________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_________________________。
方法一:(1)稀硫酸、铁屑 (2)煮沸 (3)避免生成的Fe(OH)2沉淀接触O2
方法二:(1)稀H2SO4、铁屑 (2)NaOH溶液 (3)检验试管Ⅱ出口处排出的氢气的纯度,当排出H2纯净时,再夹紧止水夹 (4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
解析:如果夹紧止水夹a时,A试管就成为一个封闭体系,反应生成的H2使A试管内压强增大,将生成的FeSO4溶液压入B中,从而发生反应生成?Fe(OH)2,而NaOH溶液中溶解的O2可将Fe(OH)2迅速氧化,最后转化成Fe(OH)3,所以看到白色沉淀的时间很短。当操作Ⅱ时,产生的H2首先通过导气管通到B中的NaOH溶液中,其中的Fe(OH)2能保持很长时间不变色。原因就是有效地排除了O2的干扰。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案 33、用下面两种方法可以制得白色的Fe(OH)2沉淀.
33、用下面两种方法可以制得白色的Fe(OH)2沉淀.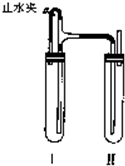 (2011?佛山二模)用下面两种方法可以制得白色的Fe(OH)2沉淀.
(2011?佛山二模)用下面两种方法可以制得白色的Fe(OH)2沉淀.