题目内容
12.某温度下,向容积为10L的密闭容器中充人1mol A气体和1mol B气体,在一定条件下发生如下反应:A(g)+B(g)?2C(g);经2s后达到平衡,测得B的浓度为0.02mol•L-1.(1)该温度下反应的平衡常数为64;
(2)若反应开始时A和B的物质的量均为2mol,达到平衡时A的转化率为80%.
分析 某温度下,向容积为10L的密闭容器中充人1mol A气体和1mol B气体,经2s后达到平衡,测得B的浓度为0.02mol•L-1,则:
A(g)+B(g)?2C(g)
起始浓度(mol/L):0.1 0.1 0
变化浓度(mol/L):0.08 0.08 0.16
平衡浓度(mol/L):0.02 0.02 0.16
(1)根据K=$\frac{{c}^{2}(C)}{c(A)×c(B)}$计算平衡常数;
(2)若反应开始时A和B的物质的量均为2mol,A、B物质的量之比与原平衡均为1:1,反应前后气体体积不变,恒温恒容下与原平衡为等效平衡,平衡时同一物质的转化率相等,而转化率=$\frac{浓度变化量}{起始浓度}$×100%.
解答 解:某温度下,向容积为10L的密闭容器中充人1mol A气体和1mol B气体,经2s后达到平衡,测得B的浓度为0.02mol•L-1,则:
A(g)+B(g)?2C(g)
起始浓度(mol/L):0.1 0.1 0
变化浓度(mol/L):0.08 0.08 0.16
平衡浓度(mol/L):0.02 0.02 0.16
(1)该温度下平衡醋酸是K=$\frac{{c}^{2}(C)}{c(A)×c(B)}$=$\frac{0.1{6}^{2}}{0.02×0.02}$=64,故答案为:64;
(2)若反应开始时A和B的物质的量均为2mol,A、B物质的量之比与原平衡均为1:1,反应前后气体体积不变,恒温恒容下与原平衡为等效平衡,平衡时同一物质的转化率相等,则A的转化率=$\frac{0.08mol/L}{0.1mol/L}$×100%=80%,故答案为:80%.
点评 本题考查化学平衡计算,难度不大,(2)中注意利用等效平衡进行分析解答,避免利用平衡常数计算的繁琐.

| A. | 碳酸钠溶液 | B. | 氯化铁溶液 | ||
| C. | 酸性高锰酸钾溶液 | D. | 溴水 |
| A. | 钠熔成光亮小球 | B. | 钠浮在水面上 | ||
| C. | 有气泡产生 | D. | 溶液质量分数为4.0% |
| A. | 使pH试纸显蓝色的溶液中:NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、Na+ | |
| B. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、NO${\;}_{3}^{-}$ | |
| C. | c(H+):c(OH-)=1012的溶液中:Mg2+、Al3+、NO${\;}_{3}^{-}$、Cl- | |
| D. | pH=0的溶液中:K+、Fe3+、SO${\;}_{4}^{2-}$、SCN- |
| A. | NH4Cl的水解方程式:NH4++H2O═NH3•H2O+H+ | |
| B. | NH3•H2O的电离方程式:NH3•H2O?NH4++OH- | |
| C. | CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- | |
| D. | HCO3-的电离方程式:HCO3-+H2O?H2CO3+OH- |
| A. | 苏打溶液中加入过量石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 用硫酸酸化的橙色的重铬酸钾(K2Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可以用于检测是否酒后驾驶:2Cr2O72-+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O | |
| C. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 表示乙醇燃烧热的热化学方程式(△H的绝对值正确):C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0kJ•mol-1 |
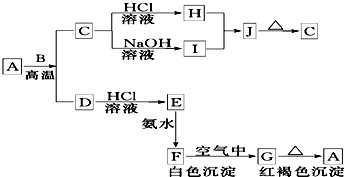 A是一种红棕色金属氧化物,B、D是金属单质,C也是一种金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体,受热后容易发生分解.
A是一种红棕色金属氧化物,B、D是金属单质,C也是一种金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体,受热后容易发生分解.