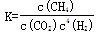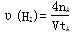题目内容
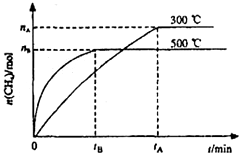 最近,各国科学家联合研制成功一种新型催化剂,可在常压下将二氧化碳与氢气混合转化为甲烷.在VL容器中进行该转化,相关情况如图所示.下列有关说法不正确的是( )
最近,各国科学家联合研制成功一种新型催化剂,可在常压下将二氧化碳与氢气混合转化为甲烷.在VL容器中进行该转化,相关情况如图所示.下列有关说法不正确的是( )A、101KPa、120℃时,该反应的平衡常数表达式K=
| ||
| B、断裂1molC=O、2molH-H所吸收的能量小于形成2molC-H、2molO-H所释放的能量 | ||
C、300℃时,从反应开始达到平衡的这段时间,化学反应速率υ(H2)=
| ||
| D、其它条件不变,减小容器体积,二氧化碳的平衡转化率增大,平衡常数不变 |
分析:A、根据常压下将二氧化碳与氢气混合转化为甲烷的化学方程式来书写化学平衡常数;
B、旧键断裂吸收能量,新键生成会释放能量,根据键能和反应的吸放热之间的关系来回答;
C、根据化学反应速率v=
来计算即可;
D、减小容器体积,即增大压强,化学平衡向着气体体积减小的方向进行.
B、旧键断裂吸收能量,新键生成会释放能量,根据键能和反应的吸放热之间的关系来回答;
C、根据化学反应速率v=
| △c |
| △t |
D、减小容器体积,即增大压强,化学平衡向着气体体积减小的方向进行.
解答:解:A、根据常压下将二氧化碳与氢气混合转化为甲烷的化学方程式为:CO2+4H2=CH4+2H2O,常压下,水是液态,所以该反应的平衡常数表达式K=
,故A错误;
B、根据图象,温度越高,则甲烷的量越少,所以化学平衡逆向移动,该反应是放热的,即断裂1molC=O、2molH-H所吸收的能量小于形成2molC-H、2molO-H所释放的能量
,故B正确;
C、根据图示信息,甲烷表示的化学反应速率v=
=
,甲烷和氢气的反应速率之比是1:4,所以氢气表示的化学反应速率v=4×
,故C正确;
D、减小容器体积,即增大压强,化学平衡向着气体体积减小的方向进行,即向正向进行,所以甲烷的转化率增大,但是温度不变,所以平衡常数不变,故D正确.
故选A.
| c(CH4)?c2(H2O) |
| c4(H2)?c(CO2) |
B、根据图象,温度越高,则甲烷的量越少,所以化学平衡逆向移动,该反应是放热的,即断裂1molC=O、2molH-H所吸收的能量小于形成2molC-H、2molO-H所释放的能量
,故B正确;
C、根据图示信息,甲烷表示的化学反应速率v=
| △c |
| △t |
| nA |
| tA |
| nA |
| tA |
D、减小容器体积,即增大压强,化学平衡向着气体体积减小的方向进行,即向正向进行,所以甲烷的转化率增大,但是温度不变,所以平衡常数不变,故D正确.
故选A.
点评:本题考查学生化学反应速率的计算以及化学平衡常数的书写知识,注意知识的归纳和整理是解题的关键,难度不大.

练习册系列答案
相关题目