题目内容
如图A、B两个装置,回答下列问题:

(1)A为_________池,Pt1为______极。
(2)当电路中通过0.02mol电子时,A溶液质量变化为_______________g;
同时B中收集到标准状况下的气体224mL,则反应前B池中原混合溶液中Cu2+的浓度是__ ______(设B中原混合液的体积为200mL)。

(1)A为_________池,Pt1为______极。
(2)当电路中通过0.02mol电子时,A溶液质量变化为_______________g;
同时B中收集到标准状况下的气体224mL,则反应前B池中原混合溶液中Cu2+的浓度是__ ______(设B中原混合液的体积为200mL)。
(1)原; 阳(各1分) (2)0.01(2分) (3)0.025mol/L (2分)
试题分析:(1)锌能和硫酸铜发生置换反应,所以A是原电池。其中锌是负极,铜是正极。B是电解池,则Pt1与电源的正极相连,做阳极,Pt2为阴极。
(2)锌电极的电极反应式是Zn-2e-=Zn2+,则当电路中通过0.02mol电子时,消耗锌的质量是0.65g。而铜电极表明生成0.64g铜,所以A中溶液增加0.65g-0.64g=0.01g。B中阳极始终是OH-放电生成氧气,电极反应式是4OH--4e-=2H2O+O2↑,根据电子得失守恒可知,生成氧气的体积是
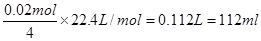 。但B中收集到标准状况下的气体224mL,这说明B中还有氢气生成,其中氢气的体积是224ml-112ml=112ml,物质的量是0.005mol。由于B中阴极首先是铜离子放电,然后是氢离子放电,电极反应式分别是Cu2++2e-=Cu、2H++2e-=H2↑,所以根据电子的得失守恒可知,析出的铜是
。但B中收集到标准状况下的气体224mL,这说明B中还有氢气生成,其中氢气的体积是224ml-112ml=112ml,物质的量是0.005mol。由于B中阴极首先是铜离子放电,然后是氢离子放电,电极反应式分别是Cu2++2e-=Cu、2H++2e-=H2↑,所以根据电子的得失守恒可知,析出的铜是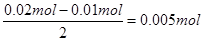 ,所以原溶液中Cu2+的浓度是0.005mol÷0.2L=0.025mol/L。
,所以原溶液中Cu2+的浓度是0.005mol÷0.2L=0.025mol/L。点评:该题是中等难度的试题,也是高考中的常见考点。试题基础性强,侧重对能力的培养和解题方法的训练与指导,有利于培养学生的逻辑思维能力和应试能力。该题的关键是利用好电子得失守恒,其次要熟练掌握离子的放电顺序。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 转变为
转变为  时,碳原子要向外界环境吸收能量
时,碳原子要向外界环境吸收能量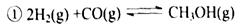


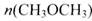 =_________mol。
=_________mol。