题目内容
10.磷化铝、磷化锌、磷化钙是目前常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦(PH3),PH3具有较强的还原性,能在空气中自燃.卫生安全标准规定,粮食中磷化物(以PH3计)含量≤0.05mg/kg.某化学兴趣小组的同学通过下列方法对粮食中残留磷化物含量进行研究:【操作流程】安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸标准溶液滴定
【实验装置】
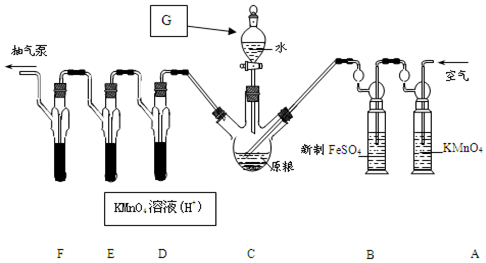
C中盛有200g原粮;D、E、F 各盛装1.00mL浓度为1.00×10-3mol/L的KMnO4溶液(H2SO4酸化).
请回答下列有关问题:
(1)仪器G的名称是分液漏斗,以磷化铝为例,写出磷化铝与水反应的化学方程式AlP+3H2O=Al(OH)3↓+PH3↑.
(2)检查C装置气密性的方法是:用止水夹夹紧C装置左右两端的橡皮管,
取下上口活塞,漏斗中加入水,打开下口旋塞,观察到水开始下滴一段时间后,不再连续下滴,表明装置气密性良好.
(3)实验过程中,用抽气泵反复抽气的目的是保证生成的PH3全部被酸性KMnO4溶液吸收.
(4)A中盛装KMnO4溶液是为除去空气中可能含有的还原(填“还原”或“氧化”)性气体; B中盛装新制FeSO4溶液的作用是除去空气中的O2;
(5)已知D、E、F中发生同一反应,实验中PH3被氧化成磷酸,写出所发生的化学反应方程式:5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O;收集装置D、E、F所得吸收液,并洗涤D、E、F,将吸收液、洗涤液一并置于锥形瓶中,加水稀释至25mL,用浓度为5×10-4mol/LNa2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为0.085mg/kg.
分析 磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦(PH3),PH3具有较强的还原性,可用KMnO4和Na2SO3测定粮食中残留磷化物含量;安装蒸馏吸收装置,A、D、E、F各装1.00mL浓度为5.00×10-4mol/L的酸性KMnO4溶液,B中装碱性焦性没食子酸(1,2,3-三羟基苯),C中装200g原粮,高锰酸钾溶液是强氧化剂可以吸收空气中的还原性气体;焦性没食子酸先和碱反应,再和氧气反应可以吸收氧气;若不吸收氧气,PH3会在氧气中燃烧,然后用高锰酸钾滴定测定PH3,然后用Na2SO3标准溶液滴定剩余的KMnO4溶液,可得磷化物含量,
(1)G是分液漏斗,磷化铝能与水或酸反应产生有毒气体膦(PH3),与水反应结合水的结构可知磷化铝能与水反应生成氢氧化铝和PH3;
(2)依据装置中的压强变化分析判断,用止水夹夹紧C装置左右两端的橡皮管,取下上口活塞,漏斗中加入水,观察水流下情况分析;
(3)准确测定膦(PH3)的含量需要全部吸收;
(4)高锰酸钾溶液是强氧化剂可以吸收还原性气体;碱性焦性没食子酸溶液,焦性没食子酸先和碱反应,再和氧气反应可以吸收氧气;若不吸收氧气,PH3会在氧气中燃烧;
(5)依据消耗的亚硫酸钠物质的量结合定量关系计算剩余高锰酸钾,计算吸收PH3需要的高锰酸钾物质的量,进一步计算PH3物质的量,得到PH3含量.
解答 解:(1)仪器G的名称是分液漏斗,依据题干信息,磷化铝和水反应,水解生成PH3和氢氧化铝,反应的化学方程式为:AlP+3H2O=Al(OH)3↓+PH3↑,
故答案为:分液漏斗;AlP+3H2O=Al(OH)3↓+PH3↑;
(2)利用装置特征,结合气体压强变化,用止水夹夹紧C装置,用止水夹夹紧C装置左右两端的橡皮管,取下上口活塞,漏斗中加入水,打开下口旋塞,观察到水开始下滴一段时间后,不再连续下滴,证明气密性完好;
故答案为:左右两端的橡皮管;水开始下滴一段时间后,不再连续下滴;
(3)准确测定PH3的含量,需要用高锰酸钾溶液全部吸收,避免产生较大误差,所以抽气泵是保证PH3全部被吸收的措施;
故答案为:保证生成的PH3全部被酸性KMnO4溶液吸收;
(4)依据装置图中装置中的试剂选择分析判断,高锰酸钾溶液是强氧化剂可以吸收空气中的还原性气体;焦性没食子酸先和碱反应,再和氧气反应可以吸收氧气;若不吸收氧气,PH3会在氧气中燃烧,用滴定方法测定的PH3减小,结果偏低;
故答案为:还原;除去空气中的O2;
(5)加水稀释至25mL,用浓度为5×10-4mol/L Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL;依据滴定反应:2KMnO4+5Na2SO3+3H2SO4=2MnSO4+K2SO4+5Na2SO4+3H2O;2KMnO4~5Na2SO3;未反应的高锰酸钾物质的量=0.0110L×5×10-4mol/L×$\frac{2}{5}$=2.2×10-6mol;与PH3反应的高锰酸钾物质的量=1.00×10-3mol/L×0.0030L-2.2×10-6mol=8.0×10-7mol;根据反应 5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O;得到定量关系为:5PH3~8KMnO4;计算得到PH3物质的量=8.0×10-7mol×$\frac{5}{8}$=5.0×10-7mol;则PH3的质量分数=$\frac{5.0×1{0}^{-7}mol×34g/mol}{0.2kg}$=0.085g/kg;
故答案为:5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O;0.085.
点评 本题以粮食中残留磷化氢的定量测定为命题背景,考查元素化合物知识氧化还原反应滴定及相关计算,综合考查了水解方程式的书写、非常规装置气密性的检验方法、实验原理的理解和定量测定的有关计算和误差分析等,题目难度中等.

| A. | “接触法”制H2SO4时,催化氧化阶段的反应原理为:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0 | |
| B. | 海水提镁的主要步骤为:海水$\stackrel{CaCO_{3}(s)}{→}$Mg(OH)2(s)$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg(l)+Cl2(g) | |
| C. | 普通水泥的主要成分是硅酸钙 | |
| D. | 黏土的主要成分是三氧化二铝. |
| A. | 用激光笔照射淀粉溶液和葡萄糖溶液,能产生光亮的“通路”的是淀粉溶液 | |
| B. | 将某气体通入淀粉碘化钾溶液中,溶液变蓝色,该气体一定是Cl2 | |
| C. | 向某溶液中加入AgNO3溶液,产生白色沉淀,该溶液中一定含Cl- | |
| D. | 向某稀溶液中加入少量NaOH溶液,未产生使湿润的红色石蕊试纸变蓝的气体,该溶液中一定 不含NH4+ |
| A. | 铜 | B. | 硝酸钾 | C. | 氢氧化钠 | D. | 纯醋酸 |
| A. | 洗涤沉淀的方法是直接向过滤器中加入适量蒸馏水,然后让水自然流下 | |
| B. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| C. | 用100ml量筒量取9.5 mL的液体 | |
| D. | 焰色反应中,观察焰色后应趁热将铂丝插入到稀硫酸中,然后再次灼烧 |
已知25℃,部分物质的溶度积常数如表:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
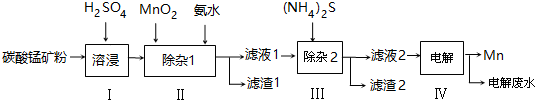
(2)则滤渣1的主要成分为Fe(OH)3(填化学式).已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;Fe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+.
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失.
(4)滤液2中,c(Co2+):c(Ni2+)=5:1.
(5)将质量为a kg的碳酸锰矿经上述流程处理后得到单质Mn b kg.若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为$\frac{(b-\frac{c}{107}×\frac{1}{2}×55)×\frac{115}{55}}{a}$×100%.(用含a、b、c的式子表达,无需化简)
| A. | 1mol•L-1NaCl溶液含有NA个Na+ | |
| B. | 1mol Cl2与足量的铝反应,转移的电子数为3NA | |
| C. | 1 mol Na 与足量O2 反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| D. | 铁和酸反应,放出标准状况下的22.4L气体,转移的电子数必为2NA |