题目内容
(17分)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上采用如下反应合成甲醇:
CO(g)+2H2(g) CH3OH(g),现模拟并分析该反应:
CH3OH(g),现模拟并分析该反应:
(1)能够说明该反应已达到平衡的是_________:
a.恒温、恒容时,容器内的压强不再变化
b.恒温、恒容时,容器内混合气体的密度不再变化
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗2molH2的同时生成1 mol CH3OH
(2)右图是该反应在不同温度下CO转化率随时间的变化曲线:
①该反应的△H____0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数:K1____K2(填“>”、“<”或“=”)。
(3)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图1所示。
①甲醇完全燃烧的化学方程式_______________________。
②请写出从C口通入O2发生的电极反应式___________________。
(4)用上述电池做电源,用图2装置电解饱和食盐水(C1、C2均为石墨电极)。
①该反应的离子方程式________________________。
②电解开始后在电极__________________的周围(填“C1”或“C2”)先出现红色。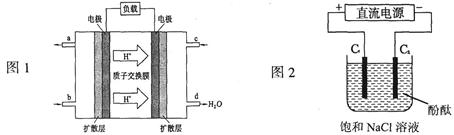
(1)ac(4分(4分,选一个对得2分,一对一错不得分):
(2)①<(2分) ②>(2分)
(3)①2CH3OH+3O2 2CO2+4H2O(2分);②O2+4e-+4H+=2H2O(2分)
2CO2+4H2O(2分);②O2+4e-+4H+=2H2O(2分)
(4)2Cl-+2H2O Cl2↑+H2↑+2OH-(3分) C2 (2分)
Cl2↑+H2↑+2OH-(3分) C2 (2分)
解析

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目

 能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景. (2012?红桥区一模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(2012?红桥区一模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.