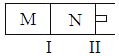��Ŀ����
����Ŀ��
��1���ñ�������ζ������NaOH��Һʱ����������ʽ�ζ��ܵĻ���������ҡ����ƿ���۾�ע��____________��ֱ�������һ���������Һ�ɻ�ɫ��Ϊ��ɫ����______________Ϊֹ��
��2�����в����п���ʹ����NaOH��Һ��Ũ����ֵƫ�͵���( )
A����ʽ�ζ���δ�ñ�������ϴ��ֱ��ע������� |
B���ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и��� |
C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ |
D����ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ��� |
��3�����ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ��ʾ�����յ����Ϊ_____________mL��

��4��ijѧ������3��ʵ��ֱ��¼�й����������
�ζ����� | ����NaOH��Һ�����/mL | 0.100 0 mol/L��������/mL | ||
�ζ�ǰ�̶� | �ζ���̶� | ��Һ���/mL | ||
��һ�� | 25.00 | 0.10 | 26.11 | 26.01 |
�ڶ��� | 25.00 | 1.56 | 30.30 | 28.74 |
������ | 25.00 | 0.32 | 26.31 | 25.99 |
�����ϱ�������ʽ�����NaOH��Һ�����ʵ���Ũ��Ϊ___________mol/L��(������λ��Ч����)
���𰸡���1����ƿ����ɫ�仯��������ڲ���ɫ����2��D��
��3��25.10����4��c(NaOH)��0.1040mol/L��
�������������������1���ζ����۾�ע����ƿ����Һ��ɫ�ı仯���ζ��յ��־���������һ����Һ����Һ�ɻ�ɫ��Ϊ��ɫ���Ұ��������ɫ���䣬˵���ζ����յ㣻(2)����c��=V����c��/V����A���ζ���δ�ñ�Һ��ϴ����ɶԱ�Һ��ϡ�ͣ���Һ��Ũ�Ƚ��ͣ�����V�����ӣ���������������Ƶ�Ũ��ƫ�ߣ��ʴ���B��û��ϴ��������NaOH�����ʵ���������Ӱ�죬�������NaOH��Ũ�Ȳ��䣬�ʴ���C������V����������NaOH��Ũ��ƫ�ߣ��ʴ���D�����ĵ�V����٣�����NaOH��Ũ��ƫС������ȷ��(3)�ζ��ܾ�ȷ��Ϊ0.01mL����˶���Ϊ25.10mL��(4)�ڶ��κ���������������������ɾ�������ƽ�����ĵ����Ϊ(26.01��25.99)/2mL=26.00mL��c(NaOH)=26.00��10��3��0.1000/25.00��10��3mol��L��1="0.104" 0 mol/L��

 ������ȫ��������ϵ�д�
������ȫ��������ϵ�д�