题目内容
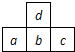 如图为周期表中短周期的一部分,若a原子最外层电子数比次外层电子数少3,则下列说法正确的是( )
如图为周期表中短周期的一部分,若a原子最外层电子数比次外层电子数少3,则下列说法正确的是( )| A、a、b、c的最高价氧化物对应水化物的酸性逐渐减弱 |
| B、a的氢化物比c的氢化物稳定 |
| C、a能形成+5价化合物 |
| D、原子半径的大小顺序是a>d>c>b |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由短周期元素在周期表中的位置,可知d处于第二周期,a、b、c处于第三周期,若a原子最外层电子数比次外层电子数少3,则其最外层电子数为8-3=5,故a为P,可推知b为S、c为Cl、d为O,
A.同周期自左而右非金属性增强,非金属性越强,最高价含氧酸的酸性越强;
B.非金属性越强,氢化物越稳定;
C.主族最高正化合价等于最外层电子数;
D.同周期自左而右原子半径减小,电子层越强原子半径越大.
A.同周期自左而右非金属性增强,非金属性越强,最高价含氧酸的酸性越强;
B.非金属性越强,氢化物越稳定;
C.主族最高正化合价等于最外层电子数;
D.同周期自左而右原子半径减小,电子层越强原子半径越大.
解答:
解:由短周期元素在周期表中的位置,可知d处于第二周期,a、b、c处于第三周期,若a原子最外层电子数比次外层电子数少3,则其最外层电子数为8-3=5,故a为P,可推知b为S、c为Cl、d为O,
A.同周期自左而右非金属性增强,非金属性越强,最高价含氧酸的酸性越强,故a、b、c的最高价氧化物对应水化物的酸性逐渐增强,故A错误;
B.非金属性a<c,非金属性越强,氢化物越稳定,故c的氢化物比a的氢化物稳定,故B错误;
C.a为P元素,原子最外层电子数为5,最高正化合价为+5,故C正确;
D.同周期自左而右原子半径减小,电子层越强原子半径越大,故原子半径:a>b>c>d,故D错误,
故选C.
A.同周期自左而右非金属性增强,非金属性越强,最高价含氧酸的酸性越强,故a、b、c的最高价氧化物对应水化物的酸性逐渐增强,故A错误;
B.非金属性a<c,非金属性越强,氢化物越稳定,故c的氢化物比a的氢化物稳定,故B错误;
C.a为P元素,原子最外层电子数为5,最高正化合价为+5,故C正确;
D.同周期自左而右原子半径减小,电子层越强原子半径越大,故原子半径:a>b>c>d,故D错误,
故选C.
点评:本题考查元素周期表与元素周期律,比较基础,侧重对元素周期律的考查,注意整体把握元素周期表的结构.

练习册系列答案
相关题目
设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A、5.6g铁粉在足量氯气中充分燃烧,失去的电子数为0.3NA | ||
| B、常温常压下,2.24L氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA | ||
C、标准状况下,1L辛烷完全燃烧后,所生成气体产物的分子数为
| ||
| D、0.1L 2mol?L-1的(NH4)2S溶液中含有的S2-数目为0.2NA |
已知ⅣA族氢化物的沸点大小顺序为CH4<SiH4<GeH4<SnH4,其主要原因为( )
| A、范德华力 | B、离子键 |
| C、共价键 | D、氢键 |
向100mL 18mol/L的浓H2SO4溶液中加入足量的铁片加热.充分反应后,产生的气体在标准状况下的体积为(提示:2Fe+6H2SO4(浓)
Fe2(SO4)3+SO2↑+6H2O)( )
| ||
| A、小于20.16L |
| B、等于20.16L |
| C、介于20.16L和40.32L之间 |
| D、等于40.32L |
1mol SO2和2mol Cl2这两种气体同时作用于石蕊溶液,可观察到的现象有( )
| A、立即褪色 | B、慢慢褪色 |
| C、先褪色后复原 | D、颜色不褪色 |
含有3.01×1024个氧原子的H2SO4的物质的量是( )
| A、0.500mol |
| B、1.00mol |
| C、2.50mol |
| D、1.25mol |
下列事实可以证明NH3是非电解质的是( )
| A、NH3是气体 |
| B、NH3水溶液显碱性 |
| C、液氨和氨水中NH3均不能电离出离子 |
| D、液氨不导电 |
设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、将2mol NO和1mol O2混合后,体系中的原子总数大于6NA |
| B、0.01mol Mg在CO2中完全燃烧,转移电子数为0.02NA |
| C、标准状况下,3.2g Cu与足量的浓硝酸反应生成气体的分子数为0.2NA |
| D、7.8g Na2O2含有的阴离子数为0.2NA |
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: