题目内容
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
(1)根据下表中数据,在该题坐标图上画出X、Z的物质的量(n)随时间(t)变化的曲线:(图中已画出Y,用铅笔作图,并在你画出的曲线末端明确标出“x”或“z”)
 (2)体系中发生反应的化学方程式是
(2)体系中发生反应的化学方程式是
(3)列式并计算该反应在0-5min时间内产物Z的平均反应速率:
(4)该反应在第
(5)若使该反应的速率增加,下列措施一定不能达到目的是
A.升高温度 B.降低温度
C.使用催化剂 D.保持容器体积不变加入1molx和2moly.
(1)根据下表中数据,在该题坐标图上画出X、Z的物质的量(n)随时间(t)变化的曲线:(图中已画出Y,用铅笔作图,并在你画出的曲线末端明确标出“x”或“z”)
| t/min | X/mol | Y/mool | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| l | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
 (2)体系中发生反应的化学方程式是
(2)体系中发生反应的化学方程式是X+2Y?2Z
X+2Y?2Z
;(3)列式并计算该反应在0-5min时间内产物Z的平均反应速率:
0.07mol?L-1?min-1
0.07mol?L-1?min-1
;(4)该反应在第
9
9
分钟(min)时达到平衡状态;(5)若使该反应的速率增加,下列措施一定不能达到目的是
B
B
.A.升高温度 B.降低温度
C.使用催化剂 D.保持容器体积不变加入1molx和2moly.
分析:(1)根据X、Z的物质的量(n)随时间(t)变化画出变化曲线;
(2)根据物质的量的变化与化学计量数呈正比书写化学方程式;
(3)根据v=
计算反应速率;
(4)根据平衡的特征判断达到平衡的时间;
(5)根据外界条件对平衡状态的影响分析.
(2)根据物质的量的变化与化学计量数呈正比书写化学方程式;
(3)根据v=
| △c |
| △t |
(4)根据平衡的特征判断达到平衡的时间;
(5)根据外界条件对平衡状态的影响分析.
解答: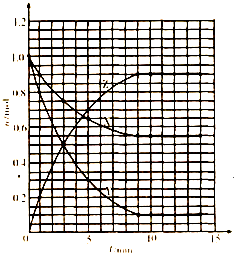 解:(1)横坐标为时间,从坐标为X、Z的物质的量(n),根据表中数据可画出曲线为:故答案为:见右图;
解:(1)横坐标为时间,从坐标为X、Z的物质的量(n),根据表中数据可画出曲线为:故答案为:见右图;
(2)由表中数据看出反应从开始到平衡,X的物质的量减小,应为反应物,0~1min物质的量变化值为1.00mol-0.90mol=0.10mol,
Y的物质的量减小,应为反应物,0~1min物质的量变化值为1.00mol-0.80mol=0.20mol,
Z的物质的量增多,应为是生成物,物质的量的变化值为0.20mol,
根据物质的量的变化与化学计量数呈正比,
则n(X):n(Y):n(Z)=0.10mol:0.20mol:0.20mol=1:2:2,
故答案为:X+2Y?2Z;
(3)0-5min时间内产物Z的平均反应速率为:
=0.07mol?L-1?min-1,故答案为:0.07mol?L-1?min-1;
(4)从表中数据可以看出,当反应达到9min时,各物质的物质的量不再发生变化,说明达到平衡状态,故答案为:9;
(5)A.升高温度反应速率增大,故A正确;
B.降低温度反应速率减小,故B错误;
C.使用催化剂能增大反应速率,故C正确;
D.保持容器体积不变加入lmolx和2moly,反应物的浓度增大,则反应速率增大,故D正确.
故答案为:B.
 解:(1)横坐标为时间,从坐标为X、Z的物质的量(n),根据表中数据可画出曲线为:故答案为:见右图;
解:(1)横坐标为时间,从坐标为X、Z的物质的量(n),根据表中数据可画出曲线为:故答案为:见右图;(2)由表中数据看出反应从开始到平衡,X的物质的量减小,应为反应物,0~1min物质的量变化值为1.00mol-0.90mol=0.10mol,
Y的物质的量减小,应为反应物,0~1min物质的量变化值为1.00mol-0.80mol=0.20mol,
Z的物质的量增多,应为是生成物,物质的量的变化值为0.20mol,
根据物质的量的变化与化学计量数呈正比,
则n(X):n(Y):n(Z)=0.10mol:0.20mol:0.20mol=1:2:2,
故答案为:X+2Y?2Z;
(3)0-5min时间内产物Z的平均反应速率为:
| ||
| 5min |
(4)从表中数据可以看出,当反应达到9min时,各物质的物质的量不再发生变化,说明达到平衡状态,故答案为:9;
(5)A.升高温度反应速率增大,故A正确;
B.降低温度反应速率减小,故B错误;
C.使用催化剂能增大反应速率,故C正确;
D.保持容器体积不变加入lmolx和2moly,反应物的浓度增大,则反应速率增大,故D正确.
故答案为:B.
点评:本题考查化学反应速率的影响因素的定量判断,题目难度中等,注意分析曲线的变化特点.

练习册系列答案
相关题目
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示. 2Z
2Z 某温度时,在2L密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析: 2C(g)
2C(g)
 2Z
2Z
 某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化
某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化