题目内容
下列反应的两物质因反应物用量不同或反应条件的不同而生成不同产物的是①Na与O2,②SO2与Ca(OH)2溶液,③C与O2,④CO2与NaOH,⑤Fe与HNO3,⑥Fe与Cl2,⑦Cu与S( )A.全部
B.除⑤⑦以外
C.除⑥⑦以外
D.①⑦
【答案】分析:①钠在少量和过量氧气中生成的产物不同;
②少量二氧化硫和石灰水反应生成亚硫酸钙,二氧化硫过量时生成亚硫酸氢钙;
③C与O2反应充分和不充分时,产物不同;
④少量二氧化碳和烧碱反应生成碳酸盐,二氧化碳过量时生成碳酸氢钠;
⑤铁和浓硝酸以及稀硝酸反应生成的产物不同,铁过量和少量是产物也不一样;
⑥铁被氯气氧化时的产物一定是氯化铁;
⑦硫只能将Cu氧化为+1价.
解答:解:①钠在少量氧气中生成氧化钠,在过量氧气中生成过氧化钠,产物不同,故①正确;
②少量二氧化硫和石灰水反应生成亚硫酸钙,二氧化硫过量时生成亚硫酸氢钙,产物不同,故②正确;
③C与O2反应充分时生成二氧化碳,不充分时生成一氧化碳,产物不同,故③正确;
④少量二氧化碳和烧碱反应生成碳酸盐,二氧化碳过量时生成碳酸氢钠,产物不同,故④正确;
⑤铁和浓硝酸反应生成二氧化氮,与稀硝酸反应生成一氧化氮,产物不同,铁少量时生成的是硝酸铁,过量时生成的是硝酸亚铁,产物不同,故⑤正确;
⑥铁被氯气氧化时的产物一定是氯化铁,故⑥错误;
⑦铜和硫反应只能生成硫化亚铜,故⑦错误.
故选C.
点评:本题考查学生物质之间反应时,用量的多少对反应产物会产生影响,可以根据所学知识来回答,难度不是很大.
②少量二氧化硫和石灰水反应生成亚硫酸钙,二氧化硫过量时生成亚硫酸氢钙;
③C与O2反应充分和不充分时,产物不同;
④少量二氧化碳和烧碱反应生成碳酸盐,二氧化碳过量时生成碳酸氢钠;
⑤铁和浓硝酸以及稀硝酸反应生成的产物不同,铁过量和少量是产物也不一样;
⑥铁被氯气氧化时的产物一定是氯化铁;
⑦硫只能将Cu氧化为+1价.
解答:解:①钠在少量氧气中生成氧化钠,在过量氧气中生成过氧化钠,产物不同,故①正确;
②少量二氧化硫和石灰水反应生成亚硫酸钙,二氧化硫过量时生成亚硫酸氢钙,产物不同,故②正确;
③C与O2反应充分时生成二氧化碳,不充分时生成一氧化碳,产物不同,故③正确;
④少量二氧化碳和烧碱反应生成碳酸盐,二氧化碳过量时生成碳酸氢钠,产物不同,故④正确;
⑤铁和浓硝酸反应生成二氧化氮,与稀硝酸反应生成一氧化氮,产物不同,铁少量时生成的是硝酸铁,过量时生成的是硝酸亚铁,产物不同,故⑤正确;
⑥铁被氯气氧化时的产物一定是氯化铁,故⑥错误;
⑦铜和硫反应只能生成硫化亚铜,故⑦错误.
故选C.
点评:本题考查学生物质之间反应时,用量的多少对反应产物会产生影响,可以根据所学知识来回答,难度不是很大.

练习册系列答案
相关题目

 的物质,该物质是一种香料.
的物质,该物质是一种香料.
 .
.

 的水解产物
的水解产物 不能经氧化反应⑥得到产品
不能经氧化反应⑥得到产品
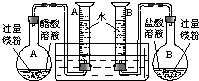 (2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.
(2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.
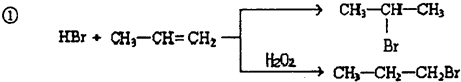




 的物质,该物质是一种香料.
的物质,该物质是一种香料.
 .
.