题目内容
12.“绿色化学”对化学反应提出了“原子经济性”的新要求,理想的原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放.下列反应类型中一定符合这一要求的是( )①取代反应 ②加成反应 ③水解反应 ④酯化反应 ⑤加聚反应.
| A. | ①② | B. | ③⑤ | C. | ②⑤ | D. | ①④ |
分析 根据“理想原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放下列反应类型”及各选项中有机反应特点进行解答.
解答 解:①取代反应过程中,有机物中的原子或原子团被其它原子或原子团所取代,反应产物不是一种,原子利用率不是100%,不符合原子经济的概念,故①错误;
②加成反应中,反应物完全转化成生成物,实现了零排放,符号绿色化学理念,故②正确;
③水解反应中生成产物不是一种,原料分子中的原子没有全部转化成所需要的产物,不满足原子经济性理念,故③错误;
④酯化反应中有水分子生成,原料分子中的原子没有全部转化成所需要的产物,故④错误;
⑤加聚反应中原料分子中的原子全部转化成所需要的产物,满足原子经济性理念,故⑤正确;
故选:C.
点评 本题考查了常见有机反应类型、绿色化学的概念,题目难度不大,注意掌握常见有机反应概念及反应原理,正确理解题干绿色化学的选项是解答本题的关键.

练习册系列答案
相关题目
18. 联氨N2H4(熔点:1.4℃,沸点:113.5℃)是一种无色的可燃液体,可用作火箭和燃料电池的燃料.结合联氨的结构判断下列说法正确的是( )
联氨N2H4(熔点:1.4℃,沸点:113.5℃)是一种无色的可燃液体,可用作火箭和燃料电池的燃料.结合联氨的结构判断下列说法正确的是( )
 联氨N2H4(熔点:1.4℃,沸点:113.5℃)是一种无色的可燃液体,可用作火箭和燃料电池的燃料.结合联氨的结构判断下列说法正确的是( )
联氨N2H4(熔点:1.4℃,沸点:113.5℃)是一种无色的可燃液体,可用作火箭和燃料电池的燃料.结合联氨的结构判断下列说法正确的是( )| A. | 联氨的晶体是原子晶体 | |
| B. | 联氨易溶于水 | |
| C. | 1 mol联氨分子中含有5NA个σ键和NA个π键 | |
| D. | 联氨分子是非极性分子 |
3.下列装置能将化学能转化为电能的是( )
| A. |  | B. |  | C. |  | D. |  |
7.下列说法不正确的是( )
| A. | 环戊二烯(  )分子中所有碳原子共平面 )分子中所有碳原子共平面 | |
| B. | 正丁烷与异丁烷互为同分异构体的依据是它们的分子式相同,但分子内碳原子的连接方式不同 | |
| C. | 七叶内酯( )和东莨菪内酯( )和东莨菪内酯( )都是某些中草药中的成分,它们具有相同的官能团,互为同系物 )都是某些中草药中的成分,它们具有相同的官能团,互为同系物 | |
| D. | 有机物(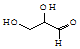 )不能与氢氧化钠发生中和反应,但能发生取代反应 )不能与氢氧化钠发生中和反应,但能发生取代反应 |
17.下列做法合理的是( )
| A. | 金属钠着火时用泡沫灭火器灭火 | |
| B. | 洗净的锥形瓶和容量瓶可以放进烘箱中烘干 | |
| C. | 酸碱滴定实验时用待测液润洗锥形瓶可以减少实验误差 | |
| D. | 做蒸馏实验时,在沸腾前发现忘记加沸石,应立即停止加热,待冷却后补加 |
4.下列物质的熔、沸点高低顺序正确的是( )
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | CI4>CBr4>CCl4>CF4 | ||
| C. | NH3>H2O>N2>CO | D. | HF>HCl>HBr>HI |
4.足量锌与浓H2SO4充分在加热下反应生成会SO2和H2的混合气体;锌和稀硫酸反应只有H2生成.现有甲乙两研究小组分别实验探究:
(1)甲研究小组按图1实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL18.5mol•L-1的浓硫酸,经过一段时间反应,Zn完全溶解

①填写仪器名称:a分液漏斗、b圆底烧瓶
②写出装置A中生成能使品红溶液褪色的化学反应方程式:Zn+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+2H2O+SO2↑.
③装置D中加入的试剂是浓硫酸.
④U型管G的作用为防止空气中的水蒸气进入干燥管影响杂质气体的检验,干扰实验.
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为防止倒吸.
⑥证明反应生成SO2和H2的实验现象是B中品红褪色,E中有红色物质生成且F中的无水硫酸铜变蓝.
⑦若A中生成标准状况下的气体33.6L,将A反应后的溶液稀释到1L,测得溶液中H+的浓度为0.1mol•L-1,则稀释液中SO42-的物质的量浓度是1.55 mol•L-1.
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行图2所示实验,分析影响反应速率的因素.
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如表所示:
分析反应过程中的水滴数,请回答:
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+),c(H+)的影响是主要因素.
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是:断开K时,反应的化学能主要转化成热能;闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高是主要影响因素,故反应速率更快.
(1)甲研究小组按图1实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL18.5mol•L-1的浓硫酸,经过一段时间反应,Zn完全溶解

①填写仪器名称:a分液漏斗、b圆底烧瓶
②写出装置A中生成能使品红溶液褪色的化学反应方程式:Zn+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+2H2O+SO2↑.
③装置D中加入的试剂是浓硫酸.
④U型管G的作用为防止空气中的水蒸气进入干燥管影响杂质气体的检验,干扰实验.
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为防止倒吸.
⑥证明反应生成SO2和H2的实验现象是B中品红褪色,E中有红色物质生成且F中的无水硫酸铜变蓝.
⑦若A中生成标准状况下的气体33.6L,将A反应后的溶液稀释到1L,测得溶液中H+的浓度为0.1mol•L-1,则稀释液中SO42-的物质的量浓度是1.55 mol•L-1.
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行图2所示实验,分析影响反应速率的因素.
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如表所示:
| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+),c(H+)的影响是主要因素.
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是:断开K时,反应的化学能主要转化成热能;闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高是主要影响因素,故反应速率更快.
5.浩瀚的海洋是一个巨大的物质宝库,工业上常用浓缩海水提取溴.

下列说法不正确的是( )

下列说法不正确的是( )
| A. | 海水的淡化方法主要有蒸馏法、电渗析法、离子交换法等 | |
| B. | 步骤②中体现了溴易挥发的性质 | |
| C. | ①-④目的是为了富集溴元素 | |
| D. | 步骤③反应的离子方程式为Br2+SO2+2H2O═2HBr+2H++SO42- |