题目内容
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法不正确的是
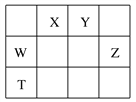
A. X、Y能形成不止一种氢化物,而Z只能形成一种
B. W和Z形成的共价化合物中,所有原子最外层均满足8电子稳定结构
C. W和T都具有良好的半导体性能
D. X和Y最多可以形成5种化合物
【答案】D
【解析】W、X、Y、Z为短周期元素,由元素在周期表中位置可知,X、Y处于第二周期,W、Z处于第三周期,令W的最外层电子数为a,则X、Y、Z最外层电子数分别为a+1、a+2、a+3,故a+a+1+a+2+a+3=22,解得a=4,故W为Si、X为N、Y为O、Z为Cl、T为Ge。A. X、Y能形成不止一种氢化物,如氨气和肼,水和双氧水,Z只能形成一种氢化物——氯化氢,故A正确;B.SiCl4中Si为+4价,Cl为-1价,各元素化合价绝对值+原子的最外层电子数=8,每个原子最外层均达到8电子稳定结构,故B正确;C.Si和Ge元素的单质都具有半导体的特性,故C正确;D. X和Y可以形成的化合物有,N2O、NO、N2O3、NO2、N2O4、N2O5,形成的化合物超过5种,故D错误;故选D。

【题目】下列说法不正确的是
A.硫元素的不同单质S2与S8互为同素异形体B.35Cl2和37Cl2互为同位素
C.(CH3)2CHCH3和CH3(CH2)2CH3互为同分异构体D.甲苯和间二甲苯互为同系物
【题目】SO2的防治与利用对于环境保护意义重大。某小组在实验室中对SO2的性质及回收利用等相关问题进行探究。
(1)用下图装置制备纯净的SO2,发生装置中反应的化学方程式为________,装置的连接顺序为:a→________(按气流方向,用小写字母表示)

(2)用如图装置探究SO2的性质。限选试剂:NaOH溶液、稀H2SO4、H2O2溶液、FeCl3溶液、 淀粉-KI溶液、新制H2S溶液。

操作步骤 | 实验现象 | 解释原因 |
用注射器将新制H2S溶液注入充满SO2的烧瓶 | 产生乳白色浑浊 | +4价S有_______性 |
用注射器将_______溶液注入充满SO2的烧瓶 | _______ | +4价S有还原性,反应的离子方程式为_______ |
(3)工业上回收利用SO2的一种途径是:
![]()
该小组在实验室探究步骤Ⅱ时,一定条件下向100mL c0mol·L-1的(NH4)2SO3溶液通入空气后,欲测定溶液中(NH4)2SO3的氧化率(α)。
①为该小组设计实验方案(不必描述操作过程的细节,物理量的数值用字母表示):______________________________________________________________________________
②α =________×100%(用实验方案中的物理量表示)。


