题目内容
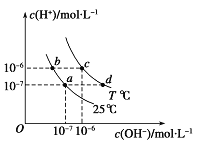
【题目】Ⅰ.25℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=1010,0.01 mol/L的BOH溶液pH=12。
(1)HA是_____(填“强电解质”或“弱电解质”,下同),BOH是____。
(2)HA的电离方程式是____、BOH的电离方程式是______。
(3)在加水稀释HA的过程中,随着水量的增加而减小的是_____(填字母)。
A.![]() B.
B.![]() C.c(H+)与c(OH-)的乘积 D.c(OH-)
C.c(H+)与c(OH-)的乘积 D.c(OH-)
(4)在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体____(填“多”、“少”或“相等”)。
Ⅱ. 在25 ℃时,请进行有关计算:(已知lg2=0.3)
(5)现有pH=2的HCl溶液100 mL,要使它的pH=3,如果加入蒸馏水,需加水___mL;如果加入pH=4的HCl溶液,需加入此HCl溶液____ mL(假定溶液体积有加和性,下同)。
(6)将pH=8的NaOH溶液与pH=11的NaOH溶液等体积混合后,溶液的pH=____。
(7)将0.1 mol·L-1盐酸和0.06 mol·L-1氢氧化钡溶液等体积混合后,该混合溶液的pH=_____。
(8)pH=a的X体积的某强酸与pH=b的Y体积的某强碱混合后,溶液呈中性,已知a+b=15,则X:Y=_____。
【答案】弱电解质 强电解质 HAH++A BOH=B++OH- B 多 900 1 000 10.7 12 10∶1
【解析】
Ⅰ. (1)-(4)KW=C(H+)C(OH-)=10-14,KW是只与温度有关的常数,0.1mol/L 的HA溶液中c(H+)=10-10,溶液中HA中的氢离子未全部电离,说明HA为弱酸,0.01mol/L的BOH溶液pH=12,溶液中氢离子浓度=0.01mol/mol,说明BOH为强碱;
Ⅱ. (5)强酸加水稀释10n倍,PH增大n个单位;强酸与强酸混合,根据混合后溶液中氢离子物质的量相等,再求所加酸的体积;
(6)将pH=8的NaOH与pH=11的NaOH溶液等体积混合,先计算出混合液中氢氧根离子浓度,然后计算出氢离子浓度及溶液的pH;
(7)先求剩余的氢氧根的浓度,再求pH;
(8)强酸和强碱混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量,根据物质的量相等计算。
(1)由分析可知,HA为弱酸为弱电解质,BOH是强碱属于强电解质,故答案为:弱电解质;强电解质;
(2)HA为弱酸存在电离平衡,电离方程式为:HAH++A-,BOH是强碱属于强电解质,电离方程式为:BOH=B++OH-;故答案为:HAH++A-;BOH=B++OH-;
(3)在加水稀释HA的过程中,促进HA电离平衡正向进行,平衡状态下的微粒浓度减小,溶液中存在离子积常数,温度不变,离子积常数不变,
A.加水稀释促进电离,加水稀释促进HA电离,n(H+)增大、n(HA)减小,溶液体积相同,所以![]() 比值增大,故A错误;
比值增大,故A错误;
B.加水稀释促进电离,加水稀释促进HA电离,n(A-)增大、n(HA)减小,溶液体积相同,所以![]() 比值减小,故B正确;
比值减小,故B正确;
C.温度不变,溶液中离子积常数不变,c(H+)与c(OH-)的乘积不变,故C错误;
D.加水稀释,溶液中氢离子浓度减小,c(H+)与c(OH-)的乘积不变,c(OH-)增大,故D错误;
故答案为:B;
(4)等pH的HA溶液和盐酸,HA是弱酸,盐酸是强酸,所以HA的物质的量浓度大于盐酸,等体积等pH的HA和盐酸,HA的物质的量大于盐酸,所以向等体积、等pH的HA溶液和盐酸中分别加入足量Zn,产生的H2是HA多,故答案为:多。
Ⅱ. (5)强酸加水稀释10n倍,PH增大n个单位,则现有pH=2的HCl溶液100mL,要使它的pH=3,则溶液的体积变为1000mL,所以要加入900ml蒸馏水;设加入入pH=4的HCl溶液V,n(H+)等量关系有:10-2×100×10-3+10-4V=10-3(V+100)×10-3,V=1L=1000mL;故答案为:900;1000;
(6)将pH=8的NaOH溶液中氢氧根离子浓度为:1×10-6mol/L,pH=11的NaOH溶液中氢氧根离子浓度为:1×10-3mol/L,两溶液等体积混合后溶液中氢氧根离子浓度为:![]() ≈5×10-4mol/L,混合液中氢离子浓度为:c(H+)=
≈5×10-4mol/L,混合液中氢离子浓度为:c(H+)=![]() =2×10-11mol/L,则混合液的pH═-lg[c(H+)]=11-lg2=9.7,故答案为:10.7;
=2×10-11mol/L,则混合液的pH═-lg[c(H+)]=11-lg2=9.7,故答案为:10.7;
(7)盐酸是一元强酸,氢氧化钡是二元强碱,将0.1mol/L盐酸和0.06mol/L氢氧化钡溶液等体积混合后,氢氧化钡有剩余,该混合溶液中氢氧根离子浓度=![]() =0.01mol/L,则氢离子浓度=
=0.01mol/L,则氢离子浓度=![]() =10-12 mol/L,所以混合溶液的pH=12,故答案为:12;
=10-12 mol/L,所以混合溶液的pH=12,故答案为:12;
(8)酸中氢离子浓度=10-a mol/L,碱中氧根离子浓度=10b-14 mol/L,则:10-a mol/L×X=10b-14 mol/L×Y,且a+b=15,解得X:Y=10:1,故答案为:10∶1。

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案