题目内容
(1)把3.84g铜放入盛有一定量浓硝酸的试管中,当收集到1.68L(标准状况)气体时,金属铜恰好全部消耗。写出有关的化学方程式,并求反应中消耗硝酸的物质的量。(2)近年来,工业上用Mg(NO3)2替代浓H2SO4作为制取浓HNO3的脱水剂(以下数据均为质量百分比浓度)。65%HNO3(质量为M1)中加72%Mg(NO3)2溶液(质量为M2)后蒸馏,分别得到97.5%HNO3和60%Mg(NO3)2溶液(不含HNO3)。
① 若蒸馏过程中HNO3,Mg(NO3)2,H2O均无损耗,求蒸馏前的投料比M1/M2的值;
②蒸馏过程中,若H2O的损耗占总质量的5.0%,即有(M1+M2)´5.0%的H2O流失。则投料时,比值M1/M2应该________(选填“增大”、“减小”或“不变”)。
答案:
解析:
解析:
| (1)化学方程式如下:
Cu+4HNO3(浓)══Cu(NO3)2+2NO2↑+2H2O, 3Cu+8HNO3(稀)══3Cu(NO3)2+2NO↑+4H2O, 若直接根据方程式去计算,就会相当繁乱,因为产生的气体1.68L中既有NO2气体,也有NO气体。若用守恒法去解此题,别有新的感觉。 由铜元素守恒: Cu——Cu(NO3)2——2HNO3 1mol 1mol
由氮元素守恒:(NO2或NO)——HNO3 1mol 1mol
所以消耗硝酸总物质的量为:
(2)①分析:因蒸馏过程中HNO3,Mg(NO3)2,H2O均无损耗而HNO3、Mg(NO3)2浓度的变化是因为HNO3溶液中的水部分转移到Mg(NO3)2溶液中,故蒸馏前后质量守恒。 蒸馏后总质量可表示为 ②增大
|

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证: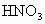 反应,当铜反应完毕时,共收集到气体的体积为0.896L(标准状况下).
反应,当铜反应完毕时,共收集到气体的体积为0.896L(标准状况下).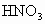 反应,当铜反应完毕时,共收集到气体的体积为0.896L(标准状况下).
反应,当铜反应完毕时,共收集到气体的体积为0.896L(标准状况下).