题目内容
【题目】钼是一种过渡金属元素,常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
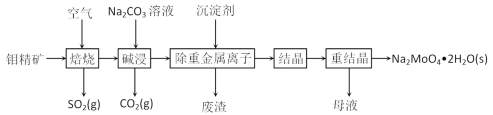
(1)提高焙烧效率的方法有:_____________(写一种)高温下发生焙烧反应的产物为MoO3,请写出该反应的化学方程式 ___________________________________。氧化产物是________________。
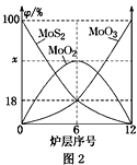
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=________。
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是___________________。
(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为 ______________________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20molL1,c(SO42-)=0.01molL1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度_____________。〔已知Ksp(BaSO4)=1×1010,Ksp(BaMoO4)=2.0×108〕
【答案】粉碎固体 2MoS2+7O2![]() 2MoO3+4SO2 MoO3、SO2 64 坩埚 MoO3+CO32-=MoO42-+CO2↑ 0.001mol/L
2MoO3+4SO2 MoO3、SO2 64 坩埚 MoO3+CO32-=MoO42-+CO2↑ 0.001mol/L
【解析】
根据流程:钼精矿(主要成分是MoS2,含少量PbS等)通入空气焙烧,MoS2转化为MoO3,反应为:2MoS2+7O2 ![]() 2MoO3+4SO2,同时2PbS+3O2
2MoO3+4SO2,同时2PbS+3O2 ![]() 2PbS+2SO2,加入碳酸钠碱浸,反应为:MoO3+Na2CO3=Na2MoO4+CO2↑,溶液还含有铅离子,加入沉淀剂Na2S,将铅离子以PbS的形式除去,废渣为PbS,溶液主要为Na2MoO4溶液,将溶液结晶、重结晶得到Na2MoO42H2O,据此分析作答。
2PbS+2SO2,加入碳酸钠碱浸,反应为:MoO3+Na2CO3=Na2MoO4+CO2↑,溶液还含有铅离子,加入沉淀剂Na2S,将铅离子以PbS的形式除去,废渣为PbS,溶液主要为Na2MoO4溶液,将溶液结晶、重结晶得到Na2MoO42H2O,据此分析作答。
(1) 粉碎固体颗粒或者通入过量的空气可以提高矿石的利用率;根据流程“焙烧”时反应的化学方程式为:2MoS2+7O2![]() 2MoO3+4SO2,其中MoS2的Mo、S元素化合价均升高,发生氧化反应,故氧化产物为MoO3和 SO2;
2MoO3+4SO2,其中MoS2的Mo、S元素化合价均升高,发生氧化反应,故氧化产物为MoO3和 SO2;
(2) 由图2可知,6层中存在的固体物质分别为MoS2、MoO3、MoO2,图象分析MoS2、MoO3的物质的量百分比均为18%,根据Mo元素守恒,则MoO2 的物质的量百分比为64%,则x为64;
(3) 由钼酸得到MoO3所用到的硅酸盐材料仪器的名称是瓷坩埚;
(4) Na2CO3的加入与焙烧后的产物即MoO3作用生成CO2↑,而生产的最终产物是钼酸钠晶体,且在后面加入的沉淀剂是为了除去杂质铅的,也就是说钼酸钠在后续过程中没有发生变化,所以反应的化学方程式为 MoO3+Na2CO3=Na2MoO4+CO2↑,则反应的离子方程式为MoO3+CO32-=MoO42-+CO2↑;
(5)已知 c(MoO42-)=0.20molL1,且Ksp(BaMoO4)=2.0×108,则当BaMoO4开始沉淀时,c(Ba2+)=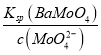 =
=![]() molL1=1.0×107molL1,此时溶液中c(SO42-)=
molL1=1.0×107molL1,此时溶液中c(SO42-)=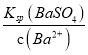 =
=![]() molL1=1.0×103molL1。
molL1=1.0×103molL1。