题目内容
下列有关说法正确的是
| A.铁的冶炼过程是通过置换反应得到单质铁 |
| B.利用电解的方法可以从海水中获得淡水 |
| C.海水提溴的过程中不发生氧化还原反应 |
| D.以贝壳、海水、盐酸为原料提炼金属镁的过程中不涉及置换反应 |
D
解析试题分析:A、铁是较活泼的金属,其冶炼是通过还原剂还原得到的,但其反应不一定是置换反应,例如CO还原氧化铁的反应就不是置换反应,A不正确;B、通过蒸馏的方法从海水中获得淡水,而不是电解,B不正确;C、溴在海水中是以离子的形成存在的,利用氧化剂可以将溴离子氧化生成单质溴,因此海水提溴的过程中一定发生氧化还原反应,C不正确;D、贝壳的主要成分是碳酸钙,高温分解生成氧化钙和CO2。氧化钙溶于水生成氢氧化钙,氢氧化钙与海水反应生成氢氧化镁。氢氧化镁溶解在盐酸中生成氯化镁和水。电解熔融氯化镁即得到金属镁,因此该过程中没有涉及到置换反应,D正确,答案选D。
考点:考查金属的冶炼、海水的综合应用

练习册系列答案
相关题目
完成下列实验所选择的试剂、装置或仪器(部分夹持装置已略去)正确的是
| | A | B | C | D |
| 实 验 | 洗涤沉淀 | 用酒精提取溴水中的Br2 | 分离CCl4和苯的混合物 | 准确量取9.50 mL水 |
| 装置或仪器 | 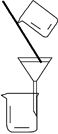 | 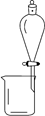 |  | 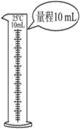 |
下列实验装置设计正确、且能达到目的的是
Ⅰ Ⅱ Ⅲ Ⅳ
| A.实验I:可用于吸收氨气,并能防止倒吸 |
| B.实验Ⅱ:静置一段时间,小试管内有晶体析出 |
| C.实验III:配制一定物质的量浓度的稀硫酸 |
| D.实验Ⅳ:海水的淡化 |
用下图所示装置进行实验,装置正确且设计合理的是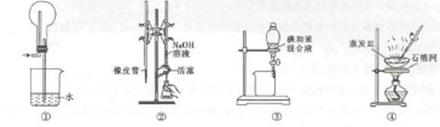
| A.图①所示装置可吸收HCl气休 |
| B.图②所示装置进行用已知浓度的NaOH溶液测定盐酸浓度的实验 |
| C.图③所示装置进行用苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗下口放出 |
| D.图④所示装置蒸发NaCl溶液,得到NaCl固体 |
准确量取25.00毫升高锰酸钾溶液,可选用的仪器是
| A.50 mL量筒 | B.25 mL量筒 |
| C.50 mL碱式滴定管 | D.50 mL酸式滴定管 |
关于下列各装置图的叙述中,不正确的是
| A.装置①中,d为阳极、c为阴极 |
| B.装置②可用于收集H2、NH3、CO2、Cl2、NO2等气体 |
| C.装置③中X若为四氯化碳,可用于吸收氨气,并防止倒吸 |
| D.装置④可用于干燥、收集氨气,并吸收多余的氨气 |
下列操作错误的是
| A.配制0.1mol·L-1的H2SO4溶液时,量取浓硫酸小心注入盛有少量蒸馏水的容量瓶中 |
| B.若要除去CO2中含有的少量SO2气体,可通过盛有饱和NaHCO3溶液的洗气瓶 |
| C.在实验室中使用金属钠时若不慎着火,可立即用细沙灭火 |
| D.测溶液pH时,可用干净的玻璃棒蘸取溶液滴到放在表面皿上的pH试纸上 |
下列实验操作及现象与实验结论一致的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液,生成白色沉淀 | 该溶液中不一定含有 |
| B | 光洁的铁钉放在冷的浓硫酸中,无明显现象 | 铁钉与冷的浓硫酸不反应 |
| C | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡静置,下层分别呈无色和紫红色 | 氧化性:Br2> Fe3+>I2 |
| D | 向浓度均为0.1mol?L-1的KCl、KI混合溶液中滴加AgNO3 | Ksp(AgCl)< Ksp (AgI) |
