题目内容
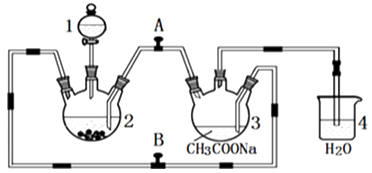
【题目】纳米级Fe3O4是一种非常重要的磁性材料,同时也可用作催化剂载体和微波吸收材料。纳米级Fe3O4有多种不同制法,用共沉淀法制备纳米四氧化三铁的流程如图所示。

(1)下列试剂可以鉴别溶液A和溶液B的是_______(填字母)。
a.K2SO4溶液 b.KMnO4溶液 c.NaOH溶液 d盐酸
(2)纳米Fe3O4投入分散剂中形成的分散系是__________。
(3)证明沉淀已经洗涤干净的操作是_________。
(4)写出生成Fe3O4的离子方程式:______________。
(5)实际生产中为提高产率,起始时所用FeSO4·7H2O和FeCl3·6H2O的物质的量之比大于1:2,原因是_____________。
【答案】 bc 胶体 取少量最后一次洗涤液于试管中,先滴加稀硝酸酸化,再滴加硝酸银溶液,不产生白色沉淀,则说明洗涤干净(或其他合理答案) Fe2++2Fe3++8OH-![]() Fe3O4 ↓+4H2O 反应过程中部分亚铁离子被氧气氧化为铁离子
Fe3O4 ↓+4H2O 反应过程中部分亚铁离子被氧气氧化为铁离子
【解析】(1)亚铁离子具有还原性,可以用酸性高锰酸钾溶液检验亚铁离子与铁离子,又因为亚铁离子与氢氧化钠溶液反应生成白色沉淀迅速变为灰绿色,最后变为红褐色,而铁离子直接生成红褐色沉淀,因此还可以用氢氧化钠溶液鉴别,硫酸钾、盐酸与二者均不反应,不能鉴别,答案选bc;(2)纳米Fe3O4投入分散剂中分散质粒子直径介于1nm与100nm之间,属于胶体的范畴,得到的分散系是胶体。(3)沉淀表面含有氯离子,可以通过检验氯离子证明沉淀已经洗涤干净,其操作是取少量最后一次洗涤液于试管中,先滴加稀硝酸酸化,再滴加硝酸银溶液,不产生白色沉淀,则说明洗涤干净。(4)生成Fe3O4的反应物为Fe2+、Fe3+和OH-,根据电荷守恒可写出该离子方程式为Fe2++2Fe3++8OH-![]() Fe3O4↓+4H2O。(5)由于亚铁离子易被氧化铁离子,所以起始时所用FeSO4·7H2O和FeCl3·6H2O的物质的量之比大于1:2。
Fe3O4↓+4H2O。(5)由于亚铁离子易被氧化铁离子,所以起始时所用FeSO4·7H2O和FeCl3·6H2O的物质的量之比大于1:2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案