题目内容
将12.6g无水亚硫酸钠固体加入100mL 8mol?L-1的硫酸中以制取SO2气体,反应完全后,若溶液中含+4价硫元素的物质的总浓度为0.2mol?L-1,假定溶液体积不变,忽略容器及导管中的气体体积,求:(1)溶液中硫元素的质量.
(2)收集到SO2气体多少毫升(标准状况下)?
【答案】分析:反应的有关方程式为:Na2SO3+H2SO4=SO2↑+Na2SO4+H2O,根据溶液中含+4价硫元素的物质的总浓度为0.2mol?L-1,进而计算收集到SO2气体的体积,根据溶液中含+4价硫元素的物质的总浓度为0.2mol?L-1,以及硫酸中硫离子的物质的量计算溶液中硫元素的质量.
解答:解:(1)溶液中含+4价硫元素的物质的总浓度为0.2mol?L-1,则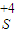 的物质的量为0.1L×0.2mol/L=0.02mol,
的物质的量为0.1L×0.2mol/L=0.02mol,
100mL 8mol?L-1的硫酸的物质的量为0.1L×8mol/L=0.8mol,
则反应后溶液中含+6价硫元素的物质的量为0.8mol,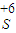 的物质的量为0.8mol,
的物质的量为0.8mol,
溶液中硫元素的质量为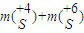 =(0.02mol+0.8mol)×32g/mol=26.2g,
=(0.02mol+0.8mol)×32g/mol=26.2g,
答:溶液中硫元素的质量为26.2g;
(2)12.6g无水亚硫酸钠固体的物质的量为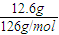 =0.1mol,溶液中剩余
=0.1mol,溶液中剩余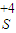 的物质的量为0.1L×0.2mol/L=0.02mol
的物质的量为0.1L×0.2mol/L=0.02mol
则反应的亚硫酸钠固体的物质的量为0.1mol-0.02mol=0.08mol,根据方程式及计算:
Na2SO3+H2SO4=SO2↑+Na2SO4+H2O
1mol 22.4L
0.08mol V
V=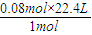 =1.792L,即1792ml,
=1.792L,即1792ml,
答:收集到SO2气体标准状况下的体积为1792ml.
点评:本题考查化学方程式的有关计算,题目难度不大,注意把握反应的化学方程式,根据质量守恒结合化学方程式计算.
解答:解:(1)溶液中含+4价硫元素的物质的总浓度为0.2mol?L-1,则
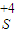 的物质的量为0.1L×0.2mol/L=0.02mol,
的物质的量为0.1L×0.2mol/L=0.02mol,100mL 8mol?L-1的硫酸的物质的量为0.1L×8mol/L=0.8mol,
则反应后溶液中含+6价硫元素的物质的量为0.8mol,
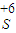 的物质的量为0.8mol,
的物质的量为0.8mol,溶液中硫元素的质量为
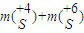 =(0.02mol+0.8mol)×32g/mol=26.2g,
=(0.02mol+0.8mol)×32g/mol=26.2g,答:溶液中硫元素的质量为26.2g;
(2)12.6g无水亚硫酸钠固体的物质的量为
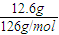 =0.1mol,溶液中剩余
=0.1mol,溶液中剩余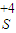 的物质的量为0.1L×0.2mol/L=0.02mol
的物质的量为0.1L×0.2mol/L=0.02mol则反应的亚硫酸钠固体的物质的量为0.1mol-0.02mol=0.08mol,根据方程式及计算:
Na2SO3+H2SO4=SO2↑+Na2SO4+H2O
1mol 22.4L
0.08mol V
V=
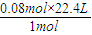 =1.792L,即1792ml,
=1.792L,即1792ml,答:收集到SO2气体标准状况下的体积为1792ml.
点评:本题考查化学方程式的有关计算,题目难度不大,注意把握反应的化学方程式,根据质量守恒结合化学方程式计算.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目