题目内容
9.某学生实验兴趣小组拟用图1装置气体排液法来完成“NaHCO3和NaCl混合物中NaHCO3含量的测定”的实验.已知:Na2CO3+CO2+H2O=2NaHCO3,CO2难溶于饱和NaHCO3溶液.
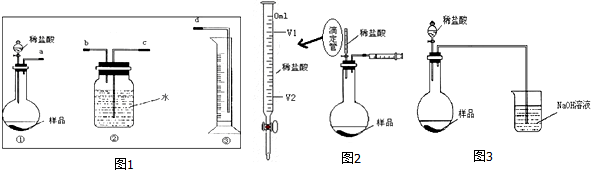
(1)各仪器接口连接顺序是a、b、c、d(用接口字母填写).
(2)甲同学认为上述方法误差较大,提出如下改进措施,你认为可行的有ABD.(填序号)
A.在装置②中水面上滴加少量植物油
B.在装置①中稀盐酸换成稀硫酸,装置②中水换成饱和NaHCO3溶液
C.在装置②中水换成饱和Na2CO3溶液
D.滴加盐酸不宜过快
(3)乙同学认为在装置②③之间的导管内会积存水,使测定结果不准,从而改用图2装置.假定滴定管(用于准确测定滴加液体体积的仪器,其中0刻度在最上面,刻度从上到下依次增大)起始读数为V1mL,终了读数为V2mL,而注射器测定排出的气体为V3mL(标准状况下),混合物样品质量为m g,则原混合物中NaHCO3的质量分数的表达式为$\frac{84({V}_{3}+{V}_{1}-{V}_{2})}{22400m}$×100%(用含V1、V2、V3、m的式子表示).
(4)丙同学改用图3装置,通过测定烧杯中NaOH溶液的增重来确定样品中NaHCO3的含量.你认为乙、丙两同学的方案中,谁的方案更合理乙同学,理由是:丙同学的方案中,生成的CO2没有全被NaOH溶液吸收,混有HCl气体,使测定的气体质量不准确_
分析 (1)NaHCO3和NaCl混合物中NaHCO3含量的测定,利用的原理是加入只组成盐酸反应用排水量气法测定生成二氧化碳的体积,进行计算碳酸氢钠含量,量气装置导气管短进长出;
(2)A、在装置②中水面上滴加少量植物油,可以防止空气中二氧化碳进入;
B、在装置①中稀盐酸换成稀硫酸,减少氯化氢挥发,装置②中水换成饱和NaHCO3溶液减少二氧化碳的溶解;
C、饱和Na2CO3溶液会和二氧化碳反应生成碳酸氢钠;
D、滴加盐酸过快CO2,CO2不能完全被吸收,排出装置C;
(3)找出二氧化碳的体积,根据碳守恒计算出碳酸氢钠的物质的量,根据m=nM计算碳酸氢钠的质量,即可求出碳酸氢钠的质量分数;
(4)丙同学的方案中,生成的CO2不能全被NaOH溶液吸收.
解答 解:(1)NaHCO3和NaCl混合物中NaHCO3含量的测定,利用的原理是加入盐酸反应用排水量气法测定生成二氧化碳的体积,进行计算碳酸氢钠含生成量,量气装置导气管短进长出,连接顺序为:a、b、c、d,
故答案为:a、b、c、d;
(2)A、在装置②中水面上滴加少量植物油,可以防止空气中二氧化碳进入影响实验测定结果,故A正确;
B、在装置①中稀盐酸换成稀硫酸,减少氯化氢挥发,装置②中水换成饱和NaHCO3溶液减少二氧化碳的溶解,减少误差,故B正确;
C、饱和Na2CO3溶液会和二氧化碳反应生成碳酸氢钠,使测定二氧化碳体积减少,故C错误;
D、滴加盐酸过快CO2,CO2不能完全被吸收,排出装置C,滴加盐酸不宜过快,故D正确;
故答案为:ABD;
(3)盐酸排出的空气的体积是(V2-V1)mL,产生的二氧化碳的体积是V3-(V2-V1),根据碳原子守恒,碳酸氢钠的物质的量是:$\frac{{V}_{3}-({V}_{2}-{V}_{1})}{22400}$mol,原样品中碳酸氢钠的质量分数为:$\frac{\frac{{V}_{3}-({V}_{2}-{V}_{1})}{22400}mol×84mol/L}{m}$×100%=$\frac{84({V}_{3}+{V}_{1}-{V}_{2})}{22400m}$×100%,
故答案为:$\frac{84({V}_{3}+{V}_{1}-{V}_{2})}{22400m}$×100%;
(4)丙同学的方案中,生成的CO2没有全被NaOH溶液吸收,所以方案更合理得为乙,
故答案为:乙同学;丙同学的方案中,生成的CO2没有全被NaOH溶液吸收,混有HCl气体,使测定的气体质量不准确.
点评 本题考查了物质组成的探究和实验设计方法分析判断,主要是气体体积测定和计算分析,掌握基础是关键,题目难度中等.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案| A. | 若a是铁,b是稀硝酸(过量)且a可溶于c溶液中.则a与b反应的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| B. | 若c,d为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪去,其褪色过程的离子方程式为SO2+Br2+2H2O═4H++SO${\;}_{4}^{2-}$+2Br- | |
| C. | 若c是无色刺激性气味的气体,其水溶液显弱碱性,在标准状况下用排空气法收集c气体得平均摩尔质量为20 g.mol-'1的混合气体进行喷泉实验.假设溶质不扩散,实验完成后所得溶液的物质的量浓度约为0. 056 mol.L-1 | |
| D. | 若a是造成温室效应的主要气体之一,c、d均为钠盐,参加反应的a、b物质的量之比为4:5,则上述反应的离子方程式为4CO2+5OH-═CO${\;}_{3}^{2-}$+3HCO${\;}_{3}^{-}$+H2O |
| A. | 金属铁 | B. | 干冰 | C. | 酒精 | D. | 硫酸钡 |

| A. | a是电源的正极 | |
| B. | 电子流动的方向:d→b | |
| C. | c极发生氧化反应 | |
| D. | 如果将c、d两电极互换,则c上也会生成黄绿色气体 |
| A. | 硫酸铜溶液 | B. | 0.5mol•L-1盐酸 | C. | 0.5mol•L-1H2SO4 | D. | 自来水 |
| A. | 1.6 a g | B. | 3.2a g | C. | (a-3.2)g | D. | (a-1.6)g |
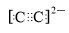 .比较E、F的两种简单离子的半径大小:E-大于(填大于或小于)F+
.比较E、F的两种简单离子的半径大小:E-大于(填大于或小于)F+