题目内容
(2012?浙江)实验室制备苯乙酮的化学方程式如图1:
制备过程中还有CH3COOH+AKl3→CH3COOAKl2+HCl↑等副反应.
主要实验装置和步骤如图2所示:
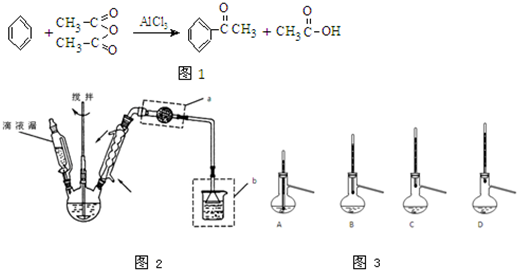
(I)合成:在三颈瓶中加入20g无水AlCl3和30mL无水苯.为避免反应液升温过快,边搅拌边慢慢滴加6mL乙酸酐和10mL无水苯的混合液,控制滴加速率,使反应液缓缓回流.滴加完毕后加热回流1小时.
(Ⅱ)分离与提纯:
①边搅拌边慢慢滴加一定量浓盐酸与冰水混合液,分离得到有机层
②水层用苯萃取,分液
③将①②所得有机层合并,洗涤、干燥、蒸去苯,得到苯乙酮粗产品
④蒸馏粗产品得到苯乙酮.回答下列问题:
(1)仪器a的名称:
(2)合成过程中要求无水操作,理由是
(3)若将乙酸酐和苯的混合液一次性倒入三颈瓶,可能导致
A.反应太剧烈B.液体太多搅不动C.反应变缓慢D.副产物增多
(4)分离和提纯操作②的目的是
(5)分液漏斗使用前须
(6)粗产品蒸馏提纯时,如图3装置中温度计位置正确的是
制备过程中还有CH3COOH+AKl3→CH3COOAKl2+HCl↑等副反应.
主要实验装置和步骤如图2所示:

(I)合成:在三颈瓶中加入20g无水AlCl3和30mL无水苯.为避免反应液升温过快,边搅拌边慢慢滴加6mL乙酸酐和10mL无水苯的混合液,控制滴加速率,使反应液缓缓回流.滴加完毕后加热回流1小时.
(Ⅱ)分离与提纯:
①边搅拌边慢慢滴加一定量浓盐酸与冰水混合液,分离得到有机层
②水层用苯萃取,分液
③将①②所得有机层合并,洗涤、干燥、蒸去苯,得到苯乙酮粗产品
④蒸馏粗产品得到苯乙酮.回答下列问题:
(1)仪器a的名称:
干燥管
干燥管
;装置b的作用:吸收HCl气体
吸收HCl气体
.(2)合成过程中要求无水操作,理由是
防止三氯化铝和乙酸酐水解
防止三氯化铝和乙酸酐水解
.(3)若将乙酸酐和苯的混合液一次性倒入三颈瓶,可能导致
AD
AD
.A.反应太剧烈B.液体太多搅不动C.反应变缓慢D.副产物增多
(4)分离和提纯操作②的目的是
把溶解在水中的苯乙酮提取出来以减少损失
把溶解在水中的苯乙酮提取出来以减少损失
.该操作中是否可改用乙醇萃取?否
否
(填“是”或“否”),原因是乙醇与水混溶
乙醇与水混溶
.(5)分液漏斗使用前须
检漏
检漏
并洗净备用.萃取时,先后加入待萃取液和萃取剂,经振摇并放气
放气
后,将分液漏斗置于铁架台的铁圈上静置片刻,分层.分离上下层液体时,应先打开上口玻璃塞
打开上口玻璃塞
,然后打开活塞放出下层液体,上层液体从上口倒出.(6)粗产品蒸馏提纯时,如图3装置中温度计位置正确的是
C
C
,可能会导致收集到的产品中混有低沸点杂质的装置是AB
AB
.分析:(1)依据装置图中的仪器和所呈试剂判断仪器的名称和作用;
(2)依据氯化铝和乙酸酐易水解分析;
(3)乙酸酐和苯反应剧烈,温度过高会生成更多的副产物;
(4)依据萃取的原理是利用物质在互不相溶的溶剂中 的溶解度不同,对混合溶液进行分离;
(5)分液操作的本质和注意问题分析判断;
(6)依据蒸馏装置的目的是控制物质的沸点,在一定温度下镏出物质;温度计水银球是测定蒸馏烧瓶支管口处的蒸气温度;
(2)依据氯化铝和乙酸酐易水解分析;
(3)乙酸酐和苯反应剧烈,温度过高会生成更多的副产物;
(4)依据萃取的原理是利用物质在互不相溶的溶剂中 的溶解度不同,对混合溶液进行分离;
(5)分液操作的本质和注意问题分析判断;
(6)依据蒸馏装置的目的是控制物质的沸点,在一定温度下镏出物质;温度计水银球是测定蒸馏烧瓶支管口处的蒸气温度;
解答:解:(1)仪器a为干燥管,装置b的作用是吸收反应过程中所产生的HCl气体;
故答案为:干燥管;吸收HCl气体;
(2)由于三氯化铝与乙酸酐极易水解,所以要求合成过程中应该无水操作;目的是防止AlCl3和乙酸酐水解;
故答案为:防止三氯化铝和乙酸酐水解;
(3)若将乙酸酐和苯的混合液一次性倒入三瓶颈,可能会导致反应太剧烈,反应液升温过快导致更多的副产物;故答案为:AD.
(4)水层用苯萃取并分液的目的是把溶解在水中的苯乙酮提取出来以减少损失,由于乙醇能与水混溶不分层,所以不能用酒精代替苯进行萃取操作;
故答案为:把溶解在水中的苯乙酮提取出来以减少损失;否,乙醇与水混溶;
(5)分液漏斗使用前需进行检漏,振摇后分液漏斗中气压增大,要不断打开活塞进行放气操作,分离液态时,放下层液体时,应该先打开上口玻璃塞(或使塞上的凹槽对准漏斗口上的小孔),然后打开下面的活塞;
故答案为:检漏;放气;打开上口玻璃塞;
(6)粗产品蒸馏提纯时,温度计的水银球要放在蒸馏烧瓶支管口处,漏斗装置中的温度计位置正确的是C项,若温度计水银球放在支管口以下位置,会导致收集的产品中 混有低沸点杂质;若温度计水银球放在支管口以上位置,会导致收集的产品中混有高沸点杂质;所以A、B项的装置容易导致低沸点杂质混入收集到的产品中;
故答案为C;AB.
故答案为:干燥管;吸收HCl气体;
(2)由于三氯化铝与乙酸酐极易水解,所以要求合成过程中应该无水操作;目的是防止AlCl3和乙酸酐水解;
故答案为:防止三氯化铝和乙酸酐水解;
(3)若将乙酸酐和苯的混合液一次性倒入三瓶颈,可能会导致反应太剧烈,反应液升温过快导致更多的副产物;故答案为:AD.
(4)水层用苯萃取并分液的目的是把溶解在水中的苯乙酮提取出来以减少损失,由于乙醇能与水混溶不分层,所以不能用酒精代替苯进行萃取操作;
故答案为:把溶解在水中的苯乙酮提取出来以减少损失;否,乙醇与水混溶;
(5)分液漏斗使用前需进行检漏,振摇后分液漏斗中气压增大,要不断打开活塞进行放气操作,分离液态时,放下层液体时,应该先打开上口玻璃塞(或使塞上的凹槽对准漏斗口上的小孔),然后打开下面的活塞;
故答案为:检漏;放气;打开上口玻璃塞;
(6)粗产品蒸馏提纯时,温度计的水银球要放在蒸馏烧瓶支管口处,漏斗装置中的温度计位置正确的是C项,若温度计水银球放在支管口以下位置,会导致收集的产品中 混有低沸点杂质;若温度计水银球放在支管口以上位置,会导致收集的产品中混有高沸点杂质;所以A、B项的装置容易导致低沸点杂质混入收集到的产品中;
故答案为C;AB.
点评:本题考查了物质制备、分离、提纯、萃取剂选择、仪器使用等试验基础知识的应用,化学实验基本知识和基本技能的掌握是解题关键,题目难度中等.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
 (2012?浙江模拟)学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.
(2012?浙江模拟)学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.