题目内容
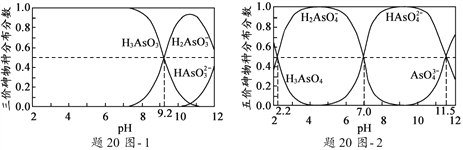
【题目】25℃时,有c(HA)+c(A-)=0.1mol/L的一组HA、KA混合溶液,溶液中c(HA)、c(A-)与pH的关系如下图所示。下列叙述不正确的是 ( )
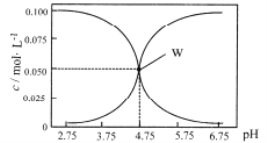
A.pH=5.75的溶液中:c(K+)>c(A-)>c(HA)> c (H+)>c(OH-)
B.欲得W点所示溶液,起始所加溶液应符合c(HA)+c(A-)=0.1mol/L且c(KA)<c(HA)
C.pH=3.75的溶液中:c(K+)+c(H+)-c(OH-)+c(HA)=0.1mol/L
D.若A-的水解常数为Kh,则lgKh=-9.25
【答案】A
【解析】
A. pH=5.75的溶液显酸性,HA的电离程度大于A-的水解程度;
B. W点的溶液中c(HA)= c(A-),酸的电离程度大于A-的水解程度,欲得W点所示溶液且满足c(HA)+c(A-)=0.1mol/L据此计算;
C. pH=3.75的溶液中存在电荷守恒,结合c(HA)+c(A-)=0.1mol/L进行计算;
D. A-+H2O![]() HA+OH-,Kh=
HA+OH-,Kh= =
= =
=![]() ,当pH=4.75时,c(HA)= c(A-),结合Ka=
,当pH=4.75时,c(HA)= c(A-),结合Ka= = c(H+)进行计算。
= c(H+)进行计算。
A. pH=5.75的溶液显酸性,HA的电离程度大于A-的水解程度,因此溶液浓度的大小关系为:c(A-) > c(K+) >c(HA)> c (H+)>c(OH-),A项错误,符合题意;
B. W点的溶液中c(HA)= c(A-),酸的电离程度大于A-的水解程度,欲得W点所示溶液满足c(HA)+c(A-)=0.1mol/L且c(KA)>c(HA),才能满足c(HA)= c(A-),B项正确,不符合题意;
C. pH=3.75的溶液中存在电荷守恒:c(K+)+c(H+)=c(OH-)+c(A-),又c(HA)+c(A-)=0.1mol/L,因此c(K+)+c(H+)-c(OH-)+c(HA)=0.1mol/L,C项正确,不符合题意;
D. 当pH=4.75时,c(HA)= c(A-),Ka= = c(H+)=10-4.75mol/L,因此Kh=
= c(H+)=10-4.75mol/L,因此Kh= =
= =
=![]() =
=![]() =10-9.25,所以lgKh=-9.25,D项正确,不符合题意;
=10-9.25,所以lgKh=-9.25,D项正确,不符合题意;
答案选A。