题目内容
(7分) 由Cl-、Br-、CO32-、SO32-、SO42-、Na+、Fe3+中若干种离子组成的化合物溶于水后得无色溶液,然后依次进行实验,观察到的现象记录如下:
①向溶液中加足量新制饱和的氯水,溶液变黄,无气体产生,再加入汽油振荡,静置,汽油层呈橙红色,用分液漏斗分离。
②向分液后所得的水溶液中加入BaCl2和盐酸的混合溶液,有白色沉淀产生,过滤。
③在滤液中加入AgNO3和HNO3的混合液,有白色沉淀产生。
请认真分析后回答下列问题:
(1)原溶液中是否含有Na+ (填“是”“否”或“无法确定”,下同。),原溶液中是否含有Cl- 。
(2)步骤①中溶液变黄的原因是(用离子方程式表示):
______________________________________________________________________。
(3)原溶液中是否含有SO32-、SO42-: (填“都有”、“都没有”、“仅有一种”或“至少有一种”)。理由是_____________________________________________________。
(1)是(1分);无法确定(1分)
(2)Cl2 + 2Br-= 2Cl-+ Br2(2分)
(3)至少有一种(1分);如果原溶液中含SO32?,在第①步中加入足量氯水后,已将其氧化成SO42?,同样会产生白色沉淀。(2分)
解析

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案(8分)室温下,将1.00mol/L盐酸滴入20.00mL 1.00mol/L氨水中,溶液pH和温度(0C)
随加入盐酸体积变化曲线如右图所示。
(1)下列有关说法正确的是___________
A.a点由水电离出的C(H+)=10-14mol/L
B.b点:
C.c点:C(Cl-)=C(NH4+)
D.d点后,容易温度略下降的主要原因是NH3·H2O电离吸热
(2)在滴加过程中,水的电离程度的变化是先 后 (填“增大”、“减小”或“不变”);
(3)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序,对应溶质的化学式和
溶液的pH。试填写表中空白:
|
| 离子浓度的关系 | 溶质 | 溶液的pH | 物料守恒关系 |
| ① | C(NH4+)>C(Cl-)>C(OH-)>C(H+) |
| pH>7 | / |
| ② |
| NH4Cl | / |
|
| ③ | C(Cl-)>C(H+)>C(NH4+)>C(OH-) |
| pH<7 | / |
(8分)室温下,将1.00mol/L盐酸滴入20.00mL 1.00mol/L氨水中,溶液pH和温度(0C)
随加入盐酸体积变化曲线如右图所示。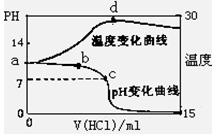
(1)下列有关说法正确的是___________
A.a点由水电离出的C(H+)=10-14mol/L
B.b点:
C.c点:C(Cl-)=C(NH4+)
D.d点后,容易温度略下降的主要原因是NH3·H2O电离吸热
(2)在滴加过程中,水的电离程度的变化是先 后 (填“增大”、“减小”或“不变”);
(3)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序,对应溶质的化学式和
溶液的pH。试填写表中空白:
| | 离子浓度的关系 | 溶质 | 溶液的pH | 物料守恒关系 |
| ① | C(NH4+)>C(Cl-)>C(OH-)>C(H+) | | pH>7 | / |
| ② | | NH4Cl | / | |
| ③ | C(Cl-)>C(H+)>C(NH4+)>C(OH-) | | pH<7 | / |