题目内容
在常温条件下,将0.05 mol·L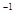 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2.用上述 NaOH溶液与某一元弱酸HA
20.0 mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10.求:(1)C( NaOH)
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2.用上述 NaOH溶液与某一元弱酸HA
20.0 mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10.求:(1)C( NaOH)
(2)C(HA)
(3)盐类水解程度的大小可用“水解度(h)”来表示。对于NaA型盐的水解度(h)表示为:
h =(已水解的物质的量÷原来总物质的量)×100﹪.求上述所得NaA溶液的水解度。
【答案】
(1)0.01 mol·L-1(2)0.005 mol·L-1(3)3%
【解析】

练习册系列答案
相关题目
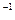 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2.用上述 NaOH溶液与某一元弱酸HA 20.0 mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10.求:(1)C( NaOH)
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2.用上述 NaOH溶液与某一元弱酸HA 20.0 mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10.求:(1)C( NaOH) 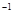 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求:
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求: