题目内容
在高压下氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构(如图)。已知晶体中N — N键的键能为160kJ·mol-1 ,而N ≡ N的键能为942kJ·mol-1 。则下列有关说法正确的是 ( )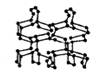
| A.高聚氮与氮气互为同位素 |
| B.14g高聚氮含3.01×1023个氮原子 |
| C.高聚氮中氮原子间的化学键为非极性键 |
| D.高聚氮转变成氮气是氧化还原反应 |
C
解析

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
NO因污染空气而“臭名昭著”,而奇妙的作用也使其成为“明星分子”。如可用于制HNO3、肥料、炸药、促进血管扩张、促进免疫功能、增强记忆等。下列各组物质中,不能生成NO的是( )
| A.Cu + HNO3(稀) | B.N2 + O2 | C.NH4Cl + O2 | D.NO2 + H2O |
下列物质的使用不涉及化学变化的是
| A.明矾用作净水剂 | B.液氨用作制冷剂 |
| C.氢氟酸刻蚀玻璃 | D.生石灰作干燥剂 |
将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2.24 L NO,剩余9.6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法中正确的是( )
| A.原混合物中铜和铁各0.15 mol | B.稀硝酸的物质的量浓度为1 mol·L-1 |
| C.第一次剩余9.6 g金属为铜和铁 | D.再加入上述200 mL稀硝酸,还会得到标准状况下2.24 L NO |
下列关于浓硝酸的叙述正确的是
| A.具有挥发性,因而浓硝酸略带有黄色 | B.具有不稳定性,实验室里应保存在棕色瓶中 |
| C.具有强氧化性,常温下可以溶解铝片 | D.具有酸性,实验室可以用它来制氢气 |
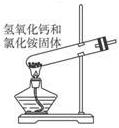
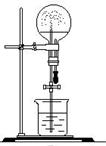
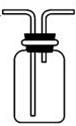
下列有关NH3的实验正确的是
| A | B | C | D | ||||||
  |

  |   |
 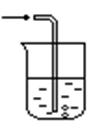 | ||||||
| 实验室制NH3 | 证明NH3极易溶于水 | 收集NH3 | 吸收多余NH3 |
某同学通过系列实验探究硫及其化合物的性质,实验现象正确且能达到目的的是
| A.点燃硫磺.产生刺激性气味气体,该气体可以漂白纸浆 |
| B.向蔗糖中加入浓硫酸,蔗糖变黑色,说明浓硫酸具有强的吸水性 |
| C.将H2S气体通入CuSO4溶液生成CuS沉淀,说明H2S为强电解质 |
| D.将Al片加入浓硫酸中,反应剧烈,说明浓硫酸具有强的氧化性 |
“封管实验”具有简易、方便、节约、绿色等优点,观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是 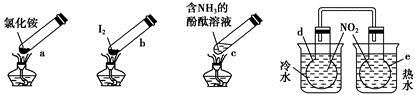
| A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体 |
| C.加热时,c中溶液红色变深,冷却后又变浅 |
| D.e内气体颜色变浅,d内气体颜色加深 |
下图所示的是验证二氧化硫性质的微型实验,a、b、c、d是浸有相关溶液的棉球。将硫酸滴入装有亚硫酸钠固体的培养皿中。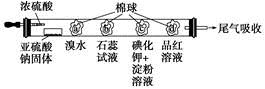
关于此实验的“现象”、“解释或结论”以及对应关系均正确的是
| 选项 | 现象 | 解释或结论 |
| A | a处黄色褪去 | 非金属性:Br>S |
| B | b处变为红色 | 二氧化硫与水反应生成酸性物质 |
| C | c处变为蓝色 | 二氧化硫具有一定的氧化性 |
| D | d处红色先褪去后恢复 | 二氧化硫具有漂白性且漂白性不稳定 |