��Ŀ����
��1�����������յ�֪ʶ�жϣ�����˵����ȷ����_________________��
A�������Ʊ���Cu(OH)2����Һ�벡����Һ���ȣ��ɼ�������Һ���Ƿ���������
B������Ͳ��ȡ5��0mLҺ��ʱ���Ӷ�������ʹҺ�����С��5��0mL
C������ƽ����20��5gij���ʣ�����������̣�ҩƷ��������
D��10���������90��������������Ͽ����50����������Һ
E������������ζ�ķ�����������ϳ���ά����ë
F�������ߡ�ҽ�þƾ���ɱ������������Ϊʹϸ���ĵ��������ʸı�
��2��������AgCl�ֱ���룺��5mLˮ�� ��10mL 0��2mol/LMgCl2��Һ����20mL 0��5mol/LNaCl��Һ��
��40mL 0��1mol/L�������ܽ�����Һ���ͣ�����Һ��Ag+��Ũ�ȷֱ�Ϊa��b��c��d�������ɴ�С������˳����______________________
��3����֪�� 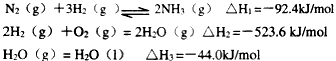
�������¡��˹��̵������о��������ڳ��¡���ѹ�����������£�N2�ڴ���(��������Fe2O3��TiO2)������ˮ������Ӧ���ɰ�������д���˷�Ӧ���Ȼ�ѧ����ʽ��____________________________
��1��ABF
��2��a>d>b>c
��3��2N2(g)+6H2O(1)=4NH3(g)+3O2(g) ��H=1650kJ/mol
��2��a>d>b>c
��3��2N2(g)+6H2O(1)=4NH3(g)+3O2(g) ��H=1650kJ/mol

��ϰ��ϵ�д�
 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д� ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�
�����Ŀ