题目内容
下列离子方程式书写正确的是
| A.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++H++OH—+SO42—=BaSO4↓+H2O |
B.用铜作电极电解硫酸溶液:2H2O 2H2↑+O2↑ 2H2↑+O2↑ |
| C.向NaClO溶液中通入过量SO2:ClO—+SO2+H2O=HClO+HSO3— |
| D.向AlCl3溶液中加入过量的Na:Al3++4Na+2H2O=AlO2—+4Na++2H2↑ |
D
解析试题分析:A、向Ba(OH)2溶液中滴加NaHSO4溶液至中性,离子方程式应为Ba2++2H++2OH—+SO42—=BaSO4↓+2H2O,错误;B、用铜作电极的阳极时阳极反应式为Cu-2e-=2Cu2+,得不到氧气,错误;C、HClO具有强氧化性,会把HSO3—氧化成SO42-,错误;D、Na与水反应生成氢氧化钠和氢气,然后铝与过量的氢氧化钠反应生成偏铝酸钠,正确,答案选D。
考点:考查离子方程式的书写

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
下列解释物质用途或现象的反应方程式不准确的是
A.硫酸型酸雨的形成会涉及反应:2H2SO3+O2 2H2SO4 2H2SO4 |
B.热的纯碱溶液可以清洗油污的原因: +2H2O +2H2O H2CO3+2OH¯ H2CO3+2OH¯ |
C.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH¯=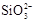 +H2O +H2O |
| D.成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl¯+ ClO¯+2H+= Cl2↑+ H2O |
下列离子方程式的书写及评价均合理的是
| 选项 | 离子方程式 | 评价 |
| A | 将1molCl2通入到含1molFeI2的溶液中: 2Fe2++2I-+2Cl2 =2Fe3++4Cl-+I2 | 正确;Cl2过量,可将 Fe2+ 、I-均氧化 |
| B | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++ HCO3-+ OH-=MgCO3↓+ H2O | 正确;酸式盐与碱反应 生成正盐和水 |
| C | 过量SO2通入到NaClO溶液中: SO2 + H2O + ClO-= HClO+HSO3- | 正确;说明酸性: H2SO3强于HClO |
| D | 1mol/L的Na [Al(OH)4]溶液和2.5mol/L的HCl溶 液等体积互相均匀混合:2[Al(OH)4]-+ 5H+ = Al3+ +Al(OH)3↓+ 5H2O | 正确;[Al(OH)4]-与 Al(OH)3消耗的H+的物 质的量之比为2:3 |
下列反应的离子方程式书写正确的是
| A.向KI溶液中通入少量氯气:Cl2+2I-=2Cl-+I2 |
| B.向AlCl3溶液中滴入少量氨水:Al3++3OH-=Al(OH)3↓ |
| C.向NaHCO3溶液中滴入少量稀硫酸:2H++CO32-=CO2↑+H2O |
| D.向Fe2(SO4)3溶液中加入少量铁粉:Fe3++Fe=2Fe2+ |
下列各组离子能大量共存,向溶液中通入足量相应气体后,各离子还能大量存在的是
| A.氯气:K+、Ba2+、SiO32-、NO3- |
| B.二氧化硫:Na+、NH4+、SO32-、C1- |
| C.氨气:K+、Na+、AlO2-、CO32- |
| D.甲醛:Ca2+、Mg2+、MnO4-、NO3- |
下列有关判断正确的是
| A.0.1mol/LNa2CO3溶液:c(OH-)= 2c(H2CO3)+ c(HCO3-)+ c(H+) |
| B.能使紫色石蕊试液呈红色的溶液:Na+、NH4+、I-、NO3-可以大量共存 |
| C.任何条件下,pH=13的氢氧化钠溶液中:c(OH-)=0.1mol/L |
| D.NH4HCO3溶于过量的NaOH溶液中:HCO3-+ OH-= CO32- + H2O |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.使石蕊试液变红的溶液中:I-、MnO4—、NO3—、Na+ |
| B.含有大量Fe3+的溶液:NH4+、HCO3—、SO42—、AlO2— |
| C.水电离出c(H+)=1.0×10-12mol/L的溶液:Cl-、Na+、ClO-、NH4+ |
| D.澄清透明的溶液:Cu2+、Fe3+、SO42—、NO3— |
水溶液中能大量共存的一组离子是( )
| A.Na+、Al3+、Cl-、CO32- | B.H+、Na+、Fe2+、MnO4- |
| C.K+、Ca2+、Cl-、NO3- | D.K+、NH4+、OH-、SO42- |
某溶液中除H+、OH-外,还含有大量的Mg2+、Fe3+、Cl-,且这三种离子物质的量浓度之比为1∶1∶6。下列有关该溶液的判断正确的是( )
| A.向该溶液中加入KI溶液后,原有的五种离子物质的量不变 |
| B.向该溶液中滴加稀氢氧化钠溶液,立即出现白色沉淀 |
| C.若溶液中c(Cl-)=0.6 mol·L-1,则该溶液的pH为1 |
| D.向该溶液中加入过量铁粉,只发生置换反应 |