题目内容
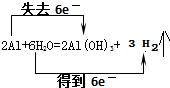
第一步:2Al+6H2O=2Al(OH)3+3H2↑
第二步:Al(OH)3+NaOH=NaAlO2+2H2O
试回答下列问题:
(1)书写金属铝与氢氧化钠溶液反应的化学方程式
(2)判断两步反应的反应类型(用四种基本反应类型作答)
①第一步属
(3)用双线桥标出以上两步反应中属于氧化还原反应的电子转移的方向和总数

(4)根据你的分析,金属铝与氢氧化钠溶液反应中氧化剂是
(2)根据反应物、生成物来分析;
(3)铝和水的反应中,铝元素的化合价由0价变为+3价,H元素的化合价由+1价变为0价;
(4)在氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂.
(2)①该反应是单质和化合物反应生成另外的单质和化合物,所以属于置换反应,故答案为:置换反应;
②该反应属于两种化合物相互交换成分生成另外两种化合物,所以属于复分解反应,故答案为:复分解反应;
(3)铝和水的反应中,铝元素的化合价由0价变为+3价,H元素的化合价由+1价变为0价,所以得失电子的最小公倍数是5,则电子转移的方向和数目为:
 ,故答案为:
,故答案为: ;
;(4)铝和水的反应中,铝元素的化合价由0价变为+3价,H元素的化合价由+1价变为0价,所以该反应中氧化剂是水,还原剂是铝,故答案为:H2O;Al.

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案(8分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。步骤一:电解精制:
请回答以下问题:电解时,阴极上的电极反应式为 ;
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
|
序号 |
反应 |
平衡常数 |
|
1 |
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
|
2 |
Au3+ + 4Cl— = AuCl4— |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:
(2)滤液含量的测定: 以下是该小组探究滤液的一个实验流程:

则100ml滤液中Fe2+的浓度为 mol·L-1
(10分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
请回答以下问题:
电解时,粗铜应与电源的 极相连。阴极上的电极反应式为
电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
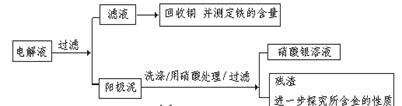
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
|
序号 |
反应 |
平衡常数 |
|
1 |
Au + 6HNO3(浓) |
<< 1 |
|
2 |
Au3+ + 4Cl— |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程:

则100mL滤液中Cu2+ 的浓度为 mol·L-1 ,Fe2+的浓度为 mol·L-1




 Au(NO3)3
+ 3NO2↑+ 3H2O
Au(NO3)3
+ 3NO2↑+ 3H2O