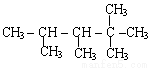题目内容
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
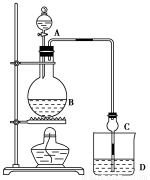
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/ ℃ | 34.7 | 78.5 | 118 | 77.1 |
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是 ;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式: 。
球形干燥管C的作用是 。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示) ;反应结束后D中的现象是 。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出 。
(1)产生醋酸、催化剂、脱水剂 CH3COOH+C2H518OH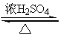 CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
(2)防止倒吸、冷凝 CO32-+H2O HCO3-+OH- 溶液分层,上层无色油状液体,下层溶液颜色变浅
HCO3-+OH- 溶液分层,上层无色油状液体,下层溶液颜色变浅
(3)乙醇
【解析】
试题分析:(1)浓硫酸的作用是产生醋酸、催化剂、脱水剂。酯化反应的脱水方式是:酸脱羟基醇脱氢。所以若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,能表示18O位置的化学方程式为:CH3COOH+C2H518OH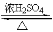 CH3CO18OC2H5+H2O。(2)球形干燥管C的作用是冷凝和防止倒吸。D中放有饱和碳酸钠溶液,反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是因为碳酸钠是强碱弱酸盐,在溶液中存在水解平衡:CO32-+H2O
CH3CO18OC2H5+H2O。(2)球形干燥管C的作用是冷凝和防止倒吸。D中放有饱和碳酸钠溶液,反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是因为碳酸钠是强碱弱酸盐,在溶液中存在水解平衡:CO32-+H2O HCO3-+OH-。HCO3-+H2O
HCO3-+OH-。HCO3-+H2O H2CO3+OH-。破坏了水的电离平衡,水继续电离,最终当溶液中达到平衡时,c(OH-)>c(H+)。所以溶液显碱性。饱和碳酸钠溶液的作用是溶解乙醇,反应消耗挥发出的乙酸,降低乙酸乙酯的溶解度。由于乙酸乙酯的密度比水小,又难溶解于水,所以会看到溶液分层,上层无色油状液体,下层溶液颜色变浅。(3)由于无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。所以先加入无水氯化钙,分离出乙醇。
H2CO3+OH-。破坏了水的电离平衡,水继续电离,最终当溶液中达到平衡时,c(OH-)>c(H+)。所以溶液显碱性。饱和碳酸钠溶液的作用是溶解乙醇,反应消耗挥发出的乙酸,降低乙酸乙酯的溶解度。由于乙酸乙酯的密度比水小,又难溶解于水,所以会看到溶液分层,上层无色油状液体,下层溶液颜色变浅。(3)由于无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。所以先加入无水氯化钙,分离出乙醇。
考点:考查乙酸乙酯的实验室制取方法的有关知识。

 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案