题目内容
10.对金属锌与浓硫酸的反应来说,下列说法不当的是( )| A. | 若金属锌足量,反应所放出的气体应为混合物 | |
| B. | 反应消耗的锌的物质的量一定等于反应生成的气体的物质的量 | |
| C. | 反应中所转移的电子的物质的量一定等于反应生成的气体的物质的量2倍 | |
| D. | 由于金属铝的活动性强于锌,所以铝与浓硫酸的反应一定比锌与浓硫酸反应剧烈 |
分析 A.锌与浓硫酸反应生成二氧化硫,与稀硫酸反应生成氢气;
B.依据锌与稀硫酸,浓硫酸反应方程式解答;
C.锌与稀硫酸,浓硫酸反应,锌都做还原剂失去电子生成二价锌离子;
D.浓硫酸具有强的氧化性,常温下与铝发生钝化.
解答 解:A.浓硫酸与金属锌反应时,浓度会逐渐减小,所以先发生反应:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,后发生反应:Zn+H2SO4(稀)═ZnSO4+H2↑,故A正确;
B.锌与浓硫酸,稀硫酸反应方程式分别为:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,Zn+H2SO4(稀)═ZnSO4+H2↑,金属锌与气体的计量数之比都为1:1,故B正确;
C.依据锌与浓硫酸,稀硫酸反应方程式:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,Zn+H2SO4(稀)═ZnSO4+H2↑,反应中的电子转移情况均为生成1mol气体转移2mol电子,故C正确;
D.浓硫酸具有强的氧化性,由于常温下金属铝在浓硫酸中发生钝化,阻止反应进行,故D错误;
故选:D.
点评 本题考查了锌与硫酸反应,明确浓硫酸、稀硫酸性质的区别是解题关键,注意铝在常温下与浓硫酸发生钝化,题目难度不大.

练习册系列答案
相关题目
20.工业合成氨反应是700K左右进行的,这主要原因是( )
| A. | 700K时此反应速率最快 | |
| B. | 700K时氨的平衡浓度最大 | |
| C. | 700K时氨的转化率最高 | |
| D. | 700K该反应的催化剂能发挥最大的作用 |
1.把下列四种X溶液分别加入四个盛有10mL 2mol•L-1盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应速率最快的是( )
| A. | 10℃20mL3 mol•L-1的X溶液 | B. | 20℃30 mL 2 mol•L-1的X溶液 | ||
| C. | 20℃10 mL 4 mol•L-1的X溶液 | D. | 10℃10 mL 2 mol•L-1的X溶液 |
18.少量的金属钠长期暴露在空气中,它的最终产物是( )
| A. | NaOH | B. | NaHCO3 | C. | Na2CO3 | D. | Na2CO3•10H2O |
5.有科学家认为:硅是“21世纪的能源”、“未来的石油”,下列有关硅可能成为新型能源的依据的叙述中不正确的是( )
| A. | 自然界存在大量硅单质 | |
| B. | 自然界的硅易开采,且可再生 | |
| C. | 硅燃料便于运输、贮存,从安全角度考虑,硅是优质燃料 | |
| D. | 硅燃料燃烧放出的热量多,其燃烧产物对环境的污染容易有效地控制 |
15.在Cu2S+2Cu2O=6Cu+SO2↑反应中(注:Cu2S 和 Cu2O中,Cu为+1价),下列说法正确的是( )
| A. | 生成1molCu,转移2mol电子 | B. | Cu是氧化产物 | ||
| C. | Cu2S既是氧化剂又是还原剂 | D. | 氧化剂只有Cu2O |
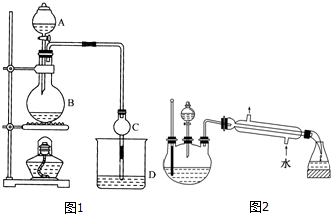
19.某课外小组设计的实验室制取乙酸乙酯的装置如图1所示,A中放有浓硫酸,B中放有乙醇(含180)、无水醋酸钠,D中放有含有酚酞饱和碳酸钠溶液.
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H50H
②有关有机物的沸点:
请回答:
(1)浓硫酸的作用是制乙酸、催化剂、吸水剂;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示180位置的化学方程式:CH3COOH+CH3CH218OH CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)上述实验中饱和碳酸钠溶液的作用是中和乙酸并吸收乙醇,减少乙酸乙酯的溶解.
(4)欲从D中得到乙酸乙酯的分离方法是分液;从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,此装置的主要优点有:(请写出两点):①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生;②增加了冷凝装置,有利于收集产物乙酸乙酯.

已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H50H
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是制乙酸、催化剂、吸水剂;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示180位置的化学方程式:CH3COOH+CH3CH218OH
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(2)球形干燥管C的作用是防止倒吸、冷凝.反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)上述实验中饱和碳酸钠溶液的作用是中和乙酸并吸收乙醇,减少乙酸乙酯的溶解.
(4)欲从D中得到乙酸乙酯的分离方法是分液;从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,此装置的主要优点有:(请写出两点):①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生;②增加了冷凝装置,有利于收集产物乙酸乙酯.
20.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),在2L的密闭容器中进行,1min后,NH3减少0.12mol,则该反应的化学反应速率是( )
| A. | v(NH3)=0.002mol(L•s) | B. | v(H2O)=0.002mol/(L•s) | ||
| C. | v(NO)=0.0015mol/(L•s) | D. | v(O2)=0.00125mol/(L•s) |