题目内容
已知:2X+Y 2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是
2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是
| A.T1时,v正>v逆 |
| B.正反应的△H<0 |
| C.a、b两点的反应速率va=vb |
| D.T<T1时,ω增大的原因是平衡向正方向移动 |
B
解析试题分析:由图像可知正反应为放热反应,T1时为平衡状态A、T1时v正<v逆,错误;C、b点温度高,故速率大,a、b两点的反应速率va<vb ,错误; D.T<T1时,ω增大的原因是反应还没有达到平衡,错误。
考点:考查化学平衡等相关知识。

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案
相关题目
在一密闭容器中,反应 aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则
| A.平衡向正反应方向移动了 | B.平衡向逆反应方向移动了 |
| C.物质B的质量分数减小了 | D.a>b |
在密闭容器中进行下列反应M(g)+N(g)  R(g)+2 L,如图所示R%是R的体积分数,t是时间,下列关于该反应的分析正确的是( )
R(g)+2 L,如图所示R%是R的体积分数,t是时间,下列关于该反应的分析正确的是( )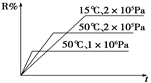
| A.正反应放热,L为气体 |
| B.正反应吸热,L为固体或纯液体 |
| C.正反应吸热,L为气体 |
| D.正反应放热,L为固体或纯液体 |
可逆反应① 、②
、②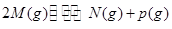 分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
下列判断正确的是:
| A.反应①的正反应是吸热反应 |
| B.在平衡(I)和平衡(II)中的气体摩尔体积相同 |
| C.达平衡(I)时X的体积分数为5/11 |
| D.达平衡(I)时体系的压强与反应开始时体系的压强之比为10:11 |
实验室用足量铁粉与一定量的某浓度的盐酸反应来制得氢气。由于反应速率太快,不易操作。为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是( )
| A.CH3COONa固体 | B.NaOH溶液 | C.(NH4)2 SO4粉末 | D.K2 SO4固体 |
可逆反应N2+3H2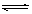 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化表示。下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化表示。下列各关系中能说明反应已达到平衡状态的是
| A.3υ正 (N2)=υ正 (H2) | B.υ正 (N2)=υ逆 (NH3) |
| C.2υ正 (H2)=3υ逆 (NH3) | D.υ正 (N2)=3υ逆 (H2) |
在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g) 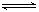 2SO3(g) ΔH <0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH <0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是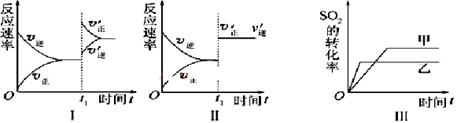
| A.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| B.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高 |
| D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
 2C(g) ΔH<0这个可逆反应的正确图像为( )
2C(g) ΔH<0这个可逆反应的正确图像为( )