题目内容
已知:A、C、J为日常生活中常见的金属单质,其中A、C均呈银白色,J呈紫红色。A是地壳中含量最高的金属元素,B是一种红棕色金属氧化物。它们之间的转化关系如下图。反应②在工业上可用于制作印刷电路板。请回答下列问题:
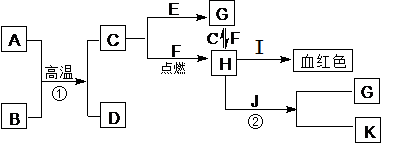
(1)写出C和I的化学式: , ;
(2)写出反应①的化学方程式: ,写出反应②的离子方程式: ;
(3)写出反应①在工业上的一种用途 。

(1)写出C和I的化学式: , ;
(2)写出反应①的化学方程式: ,写出反应②的离子方程式: ;
(3)写出反应①在工业上的一种用途 。
(1)Fe , KSCN (或NH4SCN等)
(2)2Al+Fe2O3 Al2O3+2Fe 2Fe3++Cu=Cu2++2Fe2+[每空2分]
Al2O3+2Fe 2Fe3++Cu=Cu2++2Fe2+[每空2分]
(3)焊接铁轨(合理即得分) [1分]
(2)2Al+Fe2O3
 Al2O3+2Fe 2Fe3++Cu=Cu2++2Fe2+[每空2分]
Al2O3+2Fe 2Fe3++Cu=Cu2++2Fe2+[每空2分](3)焊接铁轨(合理即得分) [1分]
试题分析:地壳中含量最高的元素是铝,所以A为铝;B为红棕色金属氧化物,B为氧化铁;二者反应生成铁和氧化铝,为2Al+Fe2O3
 Al2O3+2Fe,在工业上用来焊接铁轨、冶炼金属等;C为单质,则C为Fe,H中含有铁元素且与I生成血红色物质,可知H中有Fe3+,I为KSCN或NH4SCN,紫红色金属单质J为铜;反应②在工业上可用于制作印刷电路板,则为铜与Fe3+的反应,离子方程式为2Fe3++Cu=Cu2++2Fe2+
Al2O3+2Fe,在工业上用来焊接铁轨、冶炼金属等;C为单质,则C为Fe,H中含有铁元素且与I生成血红色物质,可知H中有Fe3+,I为KSCN或NH4SCN,紫红色金属单质J为铜;反应②在工业上可用于制作印刷电路板,则为铜与Fe3+的反应,离子方程式为2Fe3++Cu=Cu2++2Fe2+
练习册系列答案
相关题目
 Fe2O3 + 2Al
Fe2O3 + 2Al 
 CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;
CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;