题目内容
【题目】
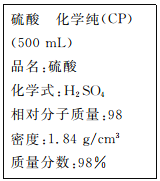
(1)该硫酸的物质的量浓度为____________mol/L。
(2)某化学小组进行硫酸酸性实验探究时,需要240 ml,4.6 mol.L-l的稀硫酸,则在配制时需要取上述浓硫酸_____________mL。
(3)叙述将上述浓硫酸进行稀释的实验操作:____________________。
(4)在配制4.6 mol.L-l稀硫酸的过程中,下列情况对所配制的硫酸溶液的物质的量浓度有何影响?
①用量筒量取浓硫酸时俯视量筒刻度线_____________(填“偏高”、“偏低”或“无影响”,下同);
②未经冷却趁热将溶液注入容量瓶中:_____________;
③仰视容量瓶刻度线定容:__________________;
④移液时不慎将少量溶液滴在容量瓶外面:_____________;
(5)实验过程中出现下列情况应如何处理?
①向容量瓶中加入蒸馏水,液面离容量瓶颈刻度线下1~2 cm时,应_____________。
②加蒸馏水时不慎超过了容量瓶颈刻度线,应_____________。
【答案】(1)18.4;(2) 62.5;(3)将量取的浓硫酸沿烧杯内壁缓缓地倒人盛有适量蒸馏水的烧杯中,同时用玻璃棒不断搅拌;(4)①偏低;②偏高;③偏低;④偏低;(5)①改用胶头滴管滴加蒸馏水至液面与刻度线相切;②重新配制。
【解析】试题分析:(1)根据c=1000ρw%/M=1000×1.84×98%/98mol·L-1=18.4mol·L-1;(2)稀释过程中,溶质的物质的量不变,同时需要的容量瓶的规格是250ml,因此有250×10-3×4.6= V×10-3×18.4,解得V=62.5mL;(3)浓硫酸的密度大于水,且遇水放出热量,因此稀释时,把浓硫酸加入到水中,具体操作是:将量取的浓硫酸沿烧杯内壁缓缓地倒人盛有适量蒸馏水的烧杯中,同时用玻璃棒不断搅拌;(4)①量筒量取液体时俯视读数,量取的液体体积减少,溶质的物质的量减少,即浓度偏低;②未经冷却,所配溶液的体积减小,即浓度偏高;③定容时仰视,所配溶液的体积增大,即浓度偏低;④造成液体溅出,容量瓶中溶质的物质的量减少,即所配溶液的浓度偏低;(5)①改用胶头滴管滴加蒸馏水至液面与刻度线相切;②重新配制。

