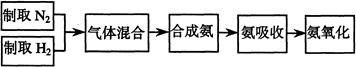
题目内容
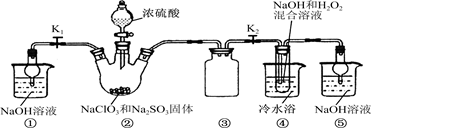
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗产品并精制的流程:
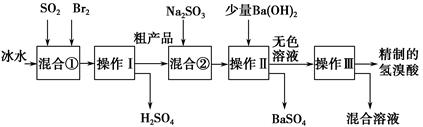
根据上述流程回答下列问题:
(1)混合①中发生反应的离子方程式为________________________________。
(2)混合①中使用冰水的目的是_______________________________________。
(3)操作Ⅲ一般适用于分离________混合物。(填序号)
a.固体和液体 b.固体和固体
c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是____________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为其中含有Fe3+,则用于证明该假设所用的试剂为________,若假设成立可观察到的现象为__________________;乙同学假设工业氢溴酸呈淡黄色是因为其中含有________________,其用于证明该假设所用的试剂为____________。

根据上述流程回答下列问题:
(1)混合①中发生反应的离子方程式为________________________________。
(2)混合①中使用冰水的目的是_______________________________________。
(3)操作Ⅲ一般适用于分离________混合物。(填序号)
a.固体和液体 b.固体和固体
c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是____________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为其中含有Fe3+,则用于证明该假设所用的试剂为________,若假设成立可观察到的现象为__________________;乙同学假设工业氢溴酸呈淡黄色是因为其中含有________________,其用于证明该假设所用的试剂为____________。
(5)KSCN溶液 溶液变成红色 Br2 CCl4(其他合理也可)
SO2与Br2在水中发生氧化还原反应,反应放热,为防止溴蒸发,用冰水降温。操作Ⅰ、Ⅲ均是蒸馏,操作Ⅱ是过滤。混合②中加入Na2SO3的目的是除去粗产品中未反应完的溴。检验Fe3+常用KSCN溶液;工业氢溴酸中可能含有溴而呈淡黄色,可用四氯化碳萃取而证明。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目