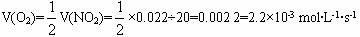题目内容
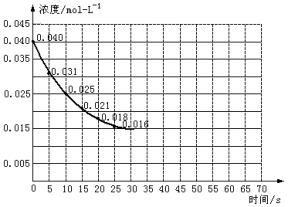
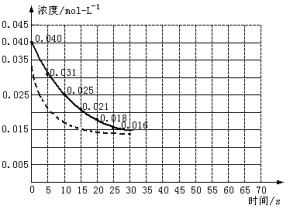
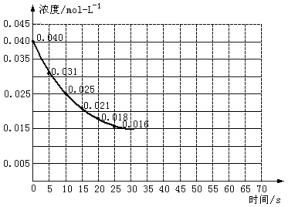
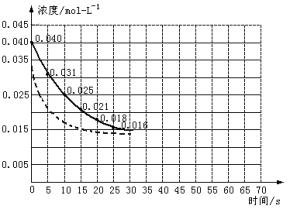
二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45 s时,达到平衡(NO2浓度约为0.0125 mol·L-1)。图24中的曲线表示二氧化氮分解反应在前25 s内的反应进程。
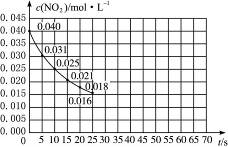
图2-4
(1)请计算前20 s内氧气的平均生成速率。
_______________________________________。
(2)若反应延续至70 s,请在上图中用实线画出25 s至70 s的反应进程曲线。
(3)若反应开始时加入催化剂(其他条件都不变)请在图上用虚线画出加入催化剂后的反应进程曲线。
(1)5.5×10-4 mol·L-1·s-1
(2)(3)略
解析:
(1)由图可知前20 s NO2消耗(0.04-0.018) mol·L-1=0.022 mol·L-1,故v(O2)=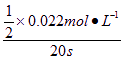 =5.5×10-4 mol·L-1·s-1。
=5.5×10-4 mol·L-1·s-1。
(2)45 s时反应体系中c(NO2)保持不变,故45~70 s时,c(NO2)仍为0.0125 mol·L-1,故25~45 s时图象应平滑下降,而45~70 s时,为水平线。(图象略)
(3)催化剂使用时可以加快反应速率,缩短到达平衡的时间,但对反应物的平衡浓度没有影响,应在原水平线的开始点前移即可。(图略)

练习册系列答案
相关题目
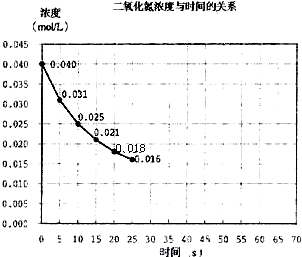 (2000?上海)二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25秒内的反应进程.
(2000?上海)二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25秒内的反应进程.