题目内容
【题目】某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
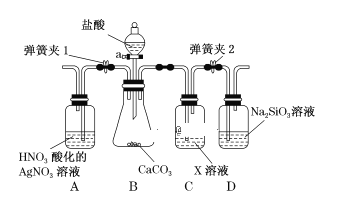
实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,…,关闭活塞a。请回答:
(1)B中反应的离子方程式是_________________________________________。
(2)通过步骤 Ⅰ、 Ⅱ 得知盐酸具有的性质是________(填字母)。
A.挥发性 B.还原性 C.氧化性 D.酸性
(3)C装置的作用是______________,X是____________________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是_______________,D中反应的化学方程式是__________________________________。
(5)碳、硅的非金属性逐渐减弱的原因是_____________________(从原子结构角度加以解释)。
【答案】(1)CaCO3 +2H+=Ca2++ CO2↑+H2O (2)D (3) 除HCl气体 NaHCO3(4)关闭弹簧夹1,打开弹簧夹2,当D中出现白色胶状沉淀后 Na2SiO3 + CO2+H2O= H2SiO3 (胶体) + Na2CO3(5)碳和硅位于同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱
【解析】
试题(1)B中是盐酸和CaCO3 反应,离子方程式为:CaCO3 +2H+=Ca2++ CO2↑+H2O。(2)盐酸可以和碳酸钙反应证明有酸性,A中有沉淀生成,说明盐酸进入到A中,则说明盐酸有挥发性,选AD。(3)通过比较碳酸和硅酸的酸性强弱来验证碳和硅两种元素非金属性的相对强弱,利用CO2和Na2SiO3反应来比较碳酸酸性和硅酸的酸性强弱,制取的CO2中混有挥发出来的HCl, 故C装置的作用是除去HCl,可以用NaHCO3溶于吸收HCl。(4)步骤Ⅱ中的操作和现象是:关闭弹簧夹1,打开弹簧夹2,当D中出现白色胶状沉淀后;化学方程式为:Na2SiO3 + CO2+H2O= H2SiO3 (胶体) + Na2CO3。(5)碳、硅的非金属性逐渐减弱的原因是碳和硅位于同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱

 阅读快车系列答案
阅读快车系列答案【题目】A、B、C、D四种不同物质之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是 ( )
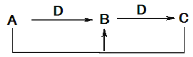
选项 | 假设 | 结论 |
A | A为NaOH溶液 | D可能是CO2 |
B | B为CO | C可能是CO2 |
C | C为FeCl2 ,D为Fe | A可能是盐酸 |
D | C为SO2 | A可能是H2S |
A. A B. B C. C D. D