题目内容
能正确表示下列反应的离子方程式是
- A.将氯化亚铁溶液和稀硝酸混合:
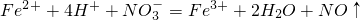
- B.将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO-
- C.向明矾溶液中加入过量的氢氧化钡溶液:
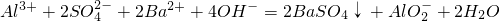
- D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
C
分析:A、氧化还原反应的电子不守恒、电荷不守恒;
B、次氯酸是弱电解质;
C、氢氧化铝溶于强碱;
D、高锰酸钾也可以氧化浓盐酸.
解答:A、氧化还原反应的电子不守恒、电荷不守恒,离子方程式为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,故A错误;
B、将氯气溶于水制备次氯酸,次氯酸是弱电解质:Cl2+H2O=H++Cl-+HClO,故B错误;
C、向明矾溶液中加入过量的氢氧化钡溶液,氢氧化铝溶于强碱;反应的离子方程式为:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O,故C正确;
D、用浓盐酸酸化的KMnO4溶液与H2O2反应,与浓盐酸反应,不能证明过氧化氢的还原性,故D错误;
故选C.
点评:本题考查了离子方程式的书写原则和注意问题,主要考查电荷守恒、电子守恒的判断,弱电解质的分析,量不同产物不同,难度中等.
分析:A、氧化还原反应的电子不守恒、电荷不守恒;
B、次氯酸是弱电解质;
C、氢氧化铝溶于强碱;
D、高锰酸钾也可以氧化浓盐酸.
解答:A、氧化还原反应的电子不守恒、电荷不守恒,离子方程式为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,故A错误;
B、将氯气溶于水制备次氯酸,次氯酸是弱电解质:Cl2+H2O=H++Cl-+HClO,故B错误;
C、向明矾溶液中加入过量的氢氧化钡溶液,氢氧化铝溶于强碱;反应的离子方程式为:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O,故C正确;
D、用浓盐酸酸化的KMnO4溶液与H2O2反应,与浓盐酸反应,不能证明过氧化氢的还原性,故D错误;
故选C.
点评:本题考查了离子方程式的书写原则和注意问题,主要考查电荷守恒、电子守恒的判断,弱电解质的分析,量不同产物不同,难度中等.

练习册系列答案
相关题目